本文整理自Nature官网上的一篇文章,原文题目为“How AI is being used to accelerate clinical trials”
如今,要将一种新药推向市场,可能需要耗费超十亿美元的资金和十年的时间,其中一半的时间和金钱是花在临床试验上,临床试验的规模越来越大、也越来越复杂。有数据显示,进入1期试验的药物中,7种药物只有1种最终会获得批准。
人工智能 (AI) 用于早期阶段的药物发现已取得重大进展,AI可以协助寻找合适的疾病靶点和设计新分子。现在研究者们也开始使用AI来管理临床试验,包括编写试验方案、招募患者和处理数据。
设计临床试验
临床试验流程的第一步是试验设计。药物应该给多大剂量?需要多少患者?应该收集哪些数据?伊利诺伊大学厄巴纳-香槟分校的计算机科学家Jimeng Sun的实验室开发了一种名为 HINT(分层交互网络)的算法,可以根据药物分子、针对疾病和患者纳入标准,来预测试验成功可能性。
他们随后开发了一个名为“SPOT(临床试验结果预测模型)”的系统,该系统考虑了试验进入训练数据的时间,并对最新试验给予更大的权重。根据预测结果,制药公司可能会改变试验设计,或尝试完全不同的药物。
美国伊利诺伊州罗斯蒙特市一家名为“Intelligent Medical Objects”的公司开发了 “SEETrials”,可以让GPT-4从临床试验摘要中提取安全性和有效性信息,从而让试验设计者能够快速了解其他研究者如何设计试验以及试验结果如何。斯坦福大学遗传学家Michael Snyder的实验室开发了一种名为“CliniDigest”的工具,可同时汇总ClinicalTrials.gov的数十条记录,并对汇总后的摘要添加引用信息。
招募最合适的患者
临床试验中最耗时的环节是患者招募,可占到研究时间的三分之一。据统计,五分之一的试验最后没有招募到所需的人数,另外,几乎所有试验都超出了预期的招募时间表。一些研究者希望在保证安全的同时放宽一些标准来加速招募进程。
生物医学数据科学家James Zou领导的斯坦福大学团队开发了一个名为“Trial Pathfinder”的系统,该系统可以分析一批已完成的临床试验,评估调整纳入标准后(例如血压阈值和淋巴细胞计数)会如何影响风险比(HR)或严重疾病/死亡等不良事件的发生率。
在一项研究中,他们将其应用于肺癌药物试验[1]。结果发现,按照“Trial Pathfinder”的建议,调整纳入标准可将使符合条件的患者数量增加一倍,且不会增加风险比。该研究表明,该系统也适用于其他类型的癌症。
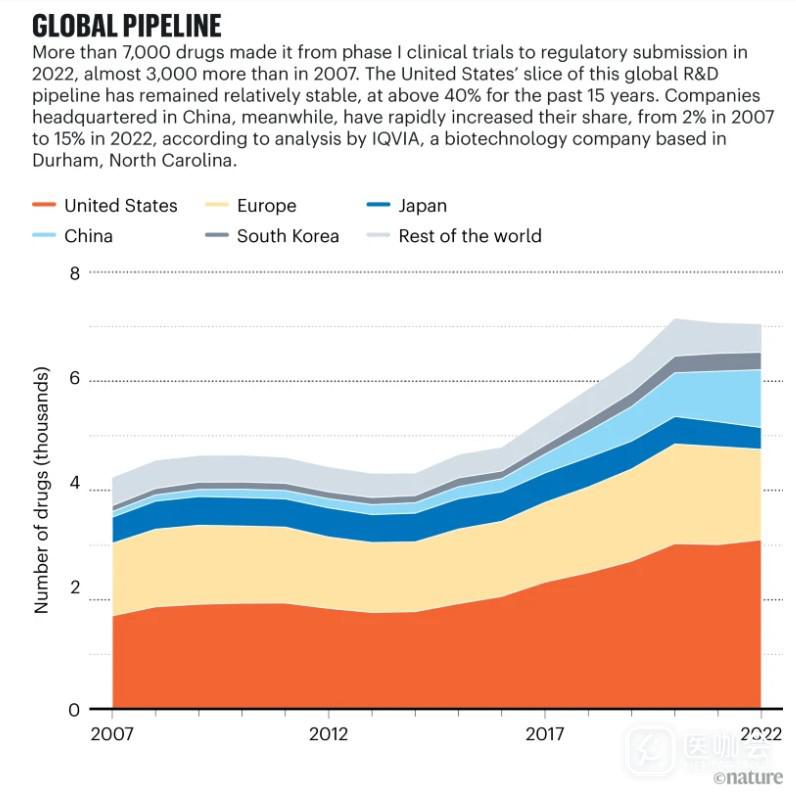
来源:IQVIA Pipeline Intelligence(2022 年 12 月)/IQVIA Institute(2023 年 1 月)
研究者一旦确定了纳入标准,就要找到符合标准的患者。纽约哥伦比亚大学生物医学信息学家Chunhua Weng的实验室开发了“Criteria2Query”。通过网络界面,用户可以用自然语言输入纳排标准,或输入试验注册号,该程序将纳入标准转换为正式的数据库查询,从而能在患者数据库中查找匹配的候选者。
Weng还开发了帮助患者寻找临床试验的方法,这是一个称为“DQueST”的系统,由两部分组成。第1部分是使用“Criteria2Query”从试验描述中提取纳入纳入标准;第2部分为患者生成相关问题,以帮助缩小搜索范围。
Sun的实验室与美国国立卫生研究院合作开发的另一个系统“TrialGPT”,可通过向大型语言模型输入提示词,为患者找到合适的试验。根据某个患者和临床试验的描述,它首先确定患者是否符合试验中的每项标准并提供解释;然后,它将这些评估汇总对每个试验评级,为患者对合适的试验进行排名。
很多试验常常不必要地排除了儿童、老年人或孕妇等人群,但AI可以找到方法将他们纳入其中。患有晚期癌症和患有罕见疾病的人特别难找到可以参加的试验。在努力寻找试验机会方面,患者有时比临床医生做更多的工作,而AI可以帮助他们与相关试验项目匹配。
AI还可以帮助减少试验所需的患者样本量。位于旧金山一家名为Unlearn的初创公司在临床试验中为患者创建数字双胞胎(digital twins)。根据试验开始时患者的数据,研究人员可以使用该数字双胞胎来预测同一患者在对照组中的情况并比较结果。Unlearn的创始人兼首席执行官Charles Fisher表示,这种方法通常可以将所需的对照组患者数量减少 20% 到 50%。Fisher表示,数字双胞胎不仅有利于研究者,也有利于参加试验的患者,因为可以降低他们接受安慰剂的机会。
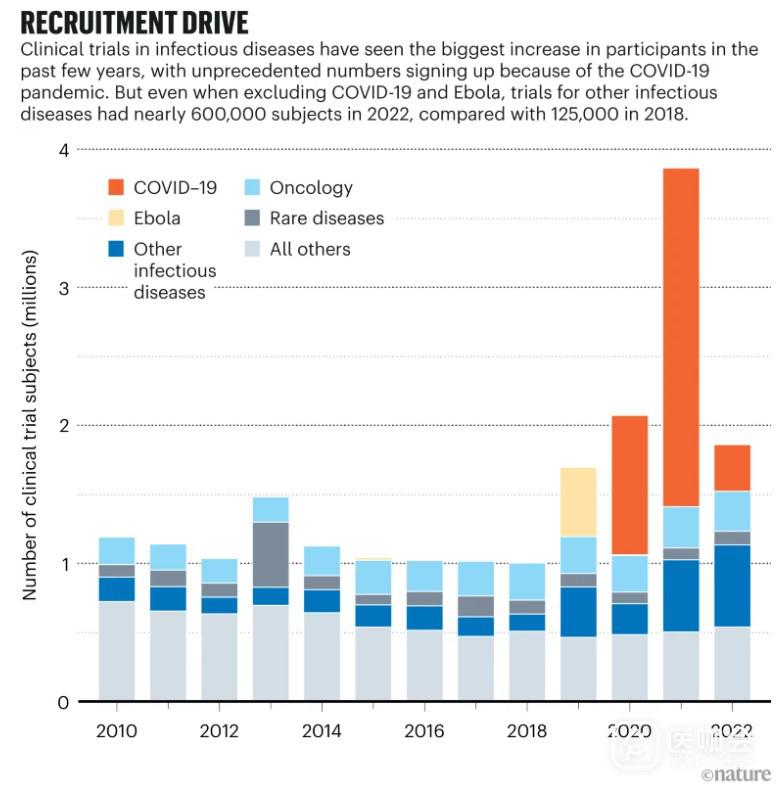
资料来源:Citeline Trialtrove/IQVIA Institute(2023 年 1 月)











确认删除