精读NEJM:基因变异与冠心病/糖尿病的发病风险
临床部分解读:阜外心血管病医院 心内科 张斌 方法学解读:医科院肿瘤医院 陈茹
一、引言
选题的重要性
2012年NEJM及JACC陆续发文证实PCSK9单克隆抗体SAR236553/REGN727可降低LDL-C达40%-70%且呈剂量依赖性。而在随后的RURHERFORD、GAUSS、LAPLACE-TIMI 57、MENDEL等研究也陆续为证实其降低LDL-C的有效性提供了大量证据。
作为充满希望的新一代的降脂药物,学界必然将其与降脂领域的主力军他汀做比较,因此评估PCSK9抑制剂的心血管收益及新发糖尿病风险成为研究的重点和热点。
2015年NEJM评价了赛诺菲公司evolocumab及Amgen公司alirocumab改善对于心血管事件的效果。但由于发生心血管事件人数较少以及新发糖尿病数据的不完整,学界对其持保守态度。为进一步评估其心血管效益,目前包括ODYSSE、FOURIER、SPIRE-1、SPIRE-2在内的四个大型RCT正在进行中。本文抓住该热点,从一个新颖的角度来预测PCSK9是否同样具有他汀类药物改善心血管事件的主角光环。
假设的科学性
研究基于“孟德尔随机”的方法:当某基因突变及某结局事件同时与暴露因素相关时,若该基因突变与结局事件之间也存在关联,则暴露因素与结局之间的关系可能具有因果性。在现有临床证据提示PCSK9抑制剂或许与他汀具有相似效益的大背景下,从基因层面作出了假设。
设计的创新性
该研究巧妙地将着眼点从PCSK9抑制剂及他汀药物本身转嫁到了其作用靶点的上游——PCSK9及HMGCR基因之上,通过建立了一套功能丧失型突变基因评分来模拟PCSK9抑制剂及HMGCR抑制剂的效应,以此比较PCSK9及HMGCR两类突变对应积分对心血管事件、新发糖尿病的影响,来推测同他汀相比PCSK9抑制剂的效果及安全性。
临床部分解读:阜外心血管病医院 心内科 张斌 方法学解读:医科院肿瘤医院 陈茹
一、引言
选题的重要性
2012年NEJM及JACC陆续发文证实PCSK9单克隆抗体SAR236553/REGN727可降低LDL-C达40%-70%且呈剂量依赖性。而在随后的RURHERFORD、GAUSS、LAPLACE-TIMI 57、MENDEL等研究也陆续为证实其降低LDL-C的有效性提供了大量证据。
作为充满希望的新一代的降脂药物,学界必然将其与降脂领域的主力军他汀做比较,因此评估PCSK9抑制剂的心血管收益及新发糖尿病风险成为研究的重点和热点。
2015年NEJM评价了赛诺菲公司evolocumab及Amgen公司alirocumab改善对于心血管事件的效果。但由于发生心血管事件人数较少以及新发糖尿病数据的不完整,学界对其持保守态度。为进一步评估其心血管效益,目前包括ODYSSE、FOURIER、SPIRE-1、SPIRE-2在内的四个大型RCT正在进行中。本文抓住该热点,从一个新颖的角度来预测PCSK9是否同样具有他汀类药物改善心血管事件的主角光环。
假设的科学性
研究基于“孟德尔随机”的方法:当某基因突变及某结局事件同时与暴露因素相关时,若该基因突变与结局事件之间也存在关联,则暴露因素与结局之间的关系可能具有因果性。在现有临床证据提示PCSK9抑制剂或许与他汀具有相似效益的大背景下,从基因层面作出了假设。
设计的创新性
该研究巧妙地将着眼点从PCSK9抑制剂及他汀药物本身转嫁到了其作用靶点的上游——PCSK9及HMGCR基因之上,通过建立了一套功能丧失型突变基因评分来模拟PCSK9抑制剂及HMGCR抑制剂的效应,以此比较PCSK9及HMGCR两类突变对应积分对心血管事件、新发糖尿病的影响,来推测同他汀相比PCSK9抑制剂的效果及安全性。
二、方法
研究对象
研究纳入了14个前瞻性队列或病例对照研究的数据,共有患者112 772例。其中,心血管患者14 120例,糖尿病患者10 635例。
遗传工具
为构建PCSK9和HMGCR的遗传评分,研究纳入了两个基因上下100kb区域内所有与LDL-C在全基因组水平相关的突变位点,且这些位点间无连锁不平衡(r2<0.2)。对于每一个位点,暴露等位基因是指与低LDL-C水平相关的位点。对每个研究对象在PCSK9和HMGCR基因的降LDL-C等位基因个数进行相加,并以每个位点对LDL-C水平的效应(mg/dl)进行加权,即可算出PCSK9和HMGCR的加权遗传评分。
研究设计
根据不同的研究目的,共包括三种研究设计:
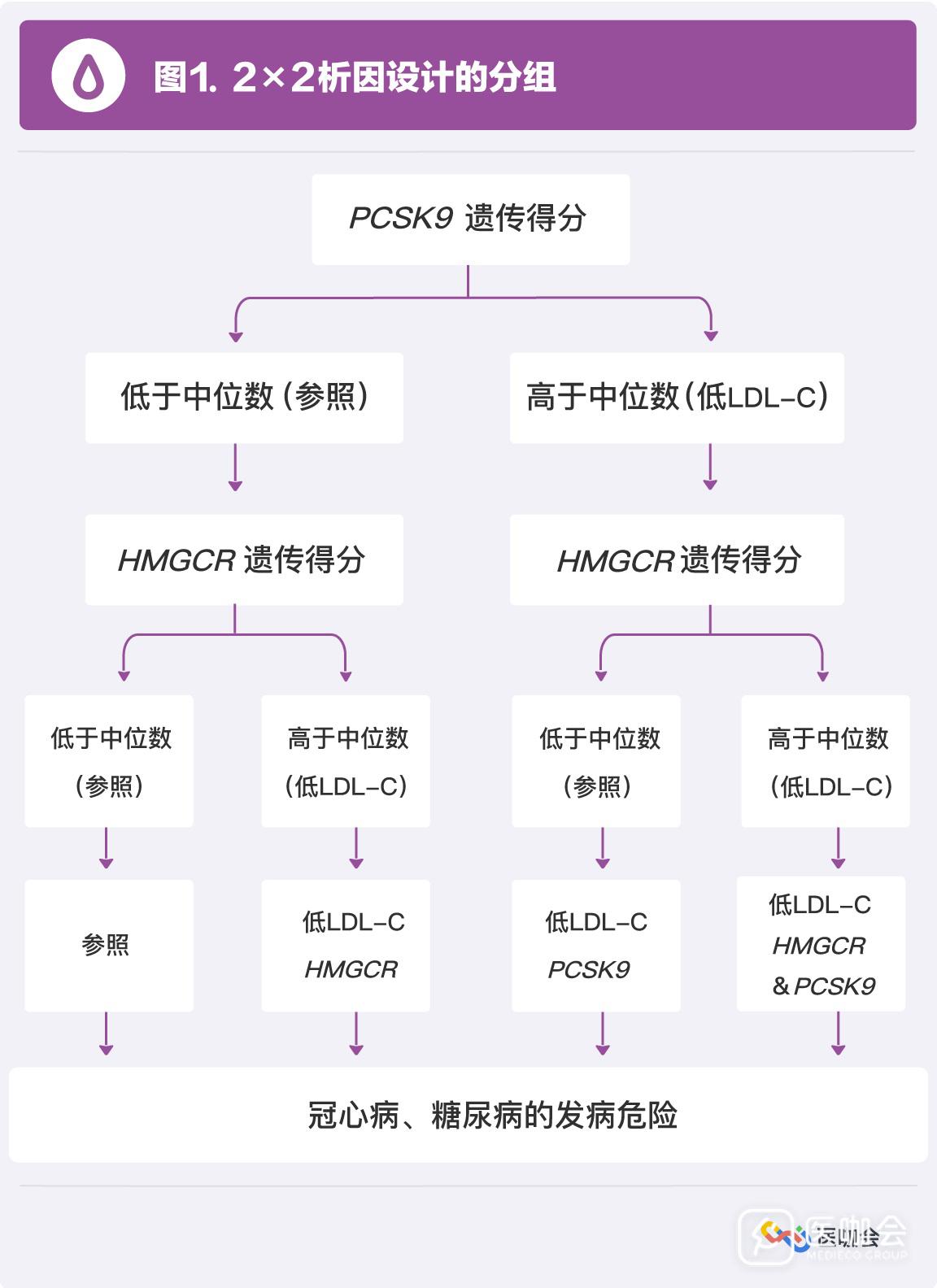
基线水平比较:根据遗传评分的中位数将研究对象均分为两组,由于每个人遗传的降LDL-C等位基因个数是随机的,这种分组结果也是随机的;
分析计量反应关系:根据遗传评分的四分位数,将研究对象均分为4组;
PCSK9和HMGCR遗传突变的单独和共同作用: 2×2析因设计,根据PCSK9和HMGCR的中位数,将研究对象分为四组(图1)。
研究结局
主要心血管病结局:首发心肌梗死或冠心病死亡;
次要心血管病结局:严重的冠状动脉或其他血管病变;
主要安全性结局:糖尿病;
次要安全性结局:空腹血糖水平、体重和BMI。
统计分析
比较研究对象的基线水平以评价分组的随机性;
采用线性回归分析不同分组研究对象的LDL-C水平差异;
采用Logistic回归分析不同分组的研究对象患心血管疾病和糖尿病的风险。
三、结果
研究对象基本特征
PCSK9基因遗传评分纳入7个位点,HMGCR基因遗传评分纳入6个位点。两组研究对象在非脂质基线特征(性别、年龄、血压、体重、BMI和吸烟史)上无显著差异,表明研究对象的分组是随机的。
心血管事件(图1)
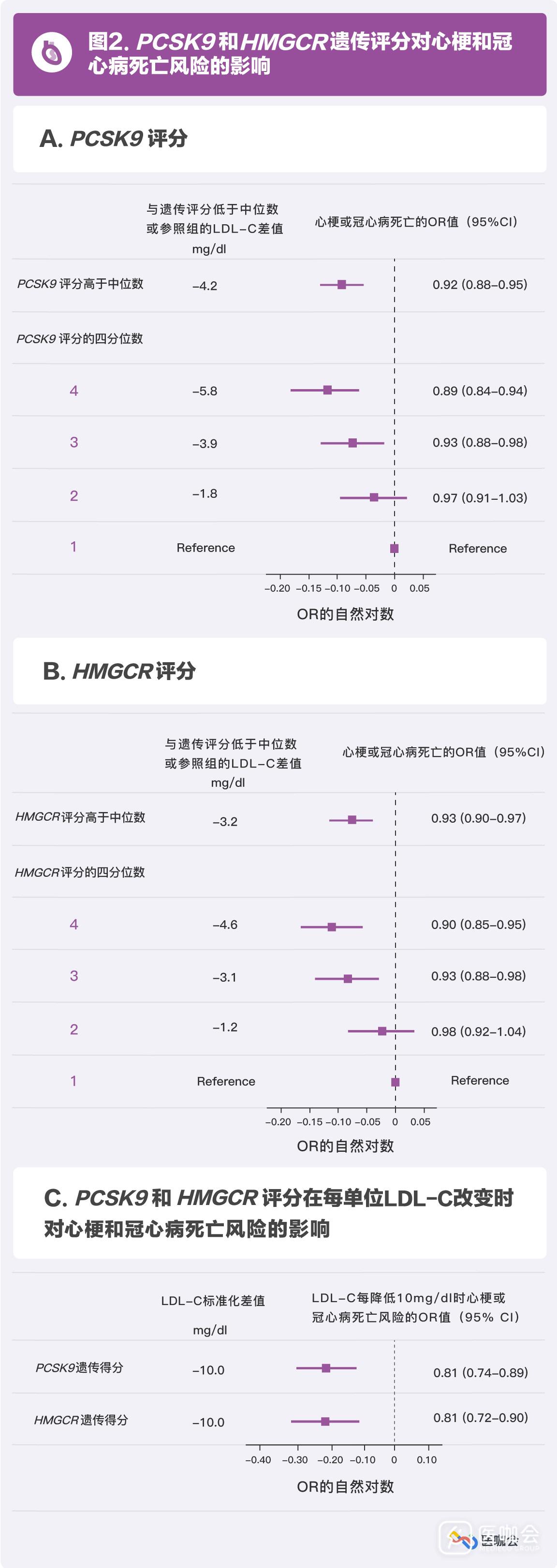
PCSK9基因高遗传评分组的研究对象,在LDL-C水平上显著低于低遗传评分组(差值为-4.2mg/dl,P=5.6×10-6),发生心梗或冠心病死亡的风险比低遗传评分组低8.4%(OR=0.92,95%CI:0.88-0.95)。(图2A)
HMGCR基因高遗传评分组的研究对象,在LDL-C水平上显著低于低遗传评分组(差值为-3.2mg/dl,P=2.9×10-15),发生心梗或冠心病死亡的风险比低遗传评分组低6.6%(OR=0.93,95%CI:0.90-0.97)。(图2B)
剂量反应分析显示,随着PCSK9和HMGCR遗传评分的增加,其LDL-C水平和相应的心梗或冠心病死亡的风险逐步降低。(图2A和2B)
研究表明PCSK9和HMGCR在降低心血管事件风险上效果相近,每降低10mg/dl LDL-C水平,PCSK9基因可以降低18.9%的心梗或冠心病死亡的风险(OR=0.81,95%CI:0.74-0.89),HMGCR基因可以降低19.1%的心梗或冠心病死亡的风险(OR=0.81,95%CI:0.72-0.90)。(图2C)
糖尿病
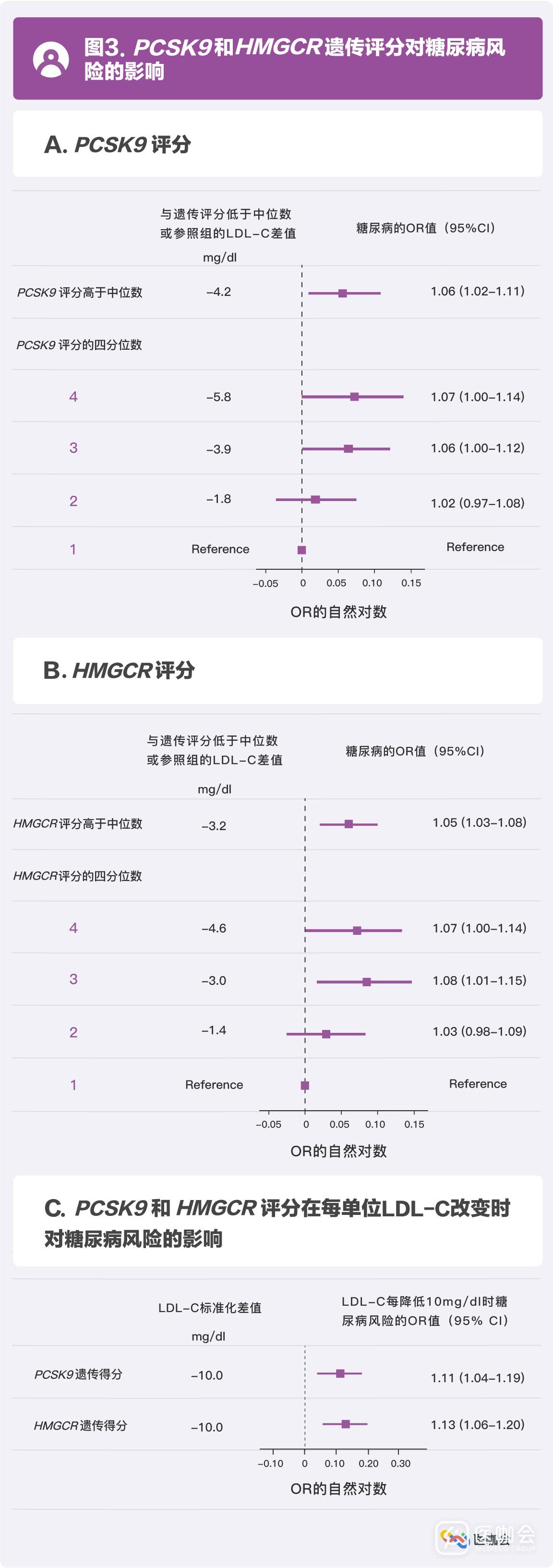
PCSK9和HMGCR基因高遗传评分组的研究对象,发生糖尿病的风险均高于低遗传评分组(OR=1.06,95%CI:1.02-1.11;OR=1.05,95%CI:1.03-1.08)。(图3A、图3B)
PCSK9和HMGCR在引发糖尿病风险上效果相近,每降低10mg/dl LDL-C水平,PCSK9基因会使糖尿病风险升高11.2%(OR=1.11,95%CI:1.04-1.19),HMGCR基因会使糖尿病风险升高12.7%(OR=1.13,95%CI:1.06-1.20)。(图3C)
PCSK9和HMGCR对糖尿病风险的升高作用仅限于空腹血糖受损的人群,其大小也低于对心血管的保护作用。
析因分析
2×2析因分析的结果显示,PCSK9和HMGCR遗传评分在LDL-C水平上及相应的心血管事件和糖尿病风险上存在加性效应。(图4)
四、讨论
解读的合理性
作者解读结果时,很好地平衡了治疗效益与安全性,从改善心血管事件及增加新发糖尿病风险两个角度给出了合理的解释。
PCSK9及HMGCR两种突变在降低心血管事件风险中的相似性提示PCSK9抑制剂与他汀应该具有相同的心血管收益。基于他汀临床研究的经验以及主流的“胆固醇假说”,降低LDL-C理论上对应心血管事件发生风险的减少。不过,从他汀多效性的角度而言,降低LDL-C的收益或许并没有理论假设的那么大。
同样,在增加新发糖尿病风险方面,两者也表现出了特别的相似性。基于结果数据的比较,心血管事件风险的降低明显高于新发糖尿病的风险。
研究的有效性及安全性终点无论对于他汀还是PCSK9抑制剂都具有重要的临床意义,作者给出了合理的解释以及对背后机制的推测,以肝脏LDL受体为主的增加介导LDL-C的逆转运,但对于某些患者胰腺细胞上的LDL受体介导胰腺内吞更多的LDL-C,这对于本身胰岛细胞失稳态的患者可能导致了糖尿病的发生。这一猜测也解释了家族性高胆固醇血症患者糖尿病患病率低的现象。
结论的客观性
文章提及基于突变的的影响比药物本身应该具有更强烈的效果,因此对于药物本身的作用,无论在心血管事件风险的降低,还是新发糖尿病风险的增加上,都产生了放大效应。不过,从生物合理性及一致性的角度,作出推测PCSK9抑制剂大概率具有与他汀相似效果的推断是合理的。
热点整理
目前,基于他汀的降脂治疗在二级预防上已经积累了大量的循证医学证据,但在一级预防目前高质量的证据并不多,针对不同性别、不同危险分层中降脂药物(他汀、PCSK9抑制剂)的心血管事件及全因死亡收益、以及肌痛和新发糖尿病的研究,还需要更多的证据支持。