JAMA子刊:肿瘤研究中,将PFS作为主要终点的一些顾虑
癌症治疗的目标是为了提高患者的生存率和/或改善生活质量。近年来,经美国食品和药物管理局(FDA)和欧洲药品管理局(EMA)批准的抗癌药物中,只有约50%被证明能改善总生存期(OS)和/或生活质量(QoL)。
目前,大多数评估抗癌药物疗效的随机临床试验都将无进展生存期(PFS)为主要终点。虽然PFS无法替代OS,但FDA和EMA都接受临床试验中将PFS的显著提高作为药物批准的标准。指定PFS而不是OS作为主要终点可能会更快地产生结果,因为肿瘤在病人死亡之前就已经发展了,所以“事件”的发生会更早。对于许多已被证明能改善PFS的新药,随后的分析显示在OS或QoL方面没有改善,但这些药物很少因此而退出市场。
近日,《JAMA Oncology》(IF=31.777)刊登了一篇文章[1],对此现象发表了一些观点(Viewpoint)。
链接:
https://jamanetwork.com/journals/jamaoncology/article-abstract/2790095
临床医生在解释以PFS为主要终点的试验时遇到的主要问题包括:
1、PFS的改善能表明有临床获益吗?
2、更长的PFS是否会转化为OS和/或QoL的获益?
PFS的改善能表明有临床获益吗?
其实,仅仅是肿瘤不再生长,就有可能带来患者QoL的改善。此外,肿瘤进展的减慢可能导致肿瘤相关症状进展的减慢。然而,使用新药治疗会增加病人对毒性的暴露,因此必须将药物的有益作用与其毒性进行权衡。如果一种新药不能改善OS,那么对病人QoL的积极和负面影响之间的平衡就决定了PFS的改善是否能带来好处。
PFS的改善与QoL的改善并不完全相关,而且也很少有高质量的关于QoL的研究,因为针对QoL的研究常常研究的是非随机的亚组病人或报告QoL的平均分数,而不是QoL改善或恶化的病人比例。这类似于在测量各组患者的平均肿瘤大小时,其中一些肿瘤生长,另一些则消退,而不是测量有肿瘤应答效益(tumor response)的患者比例。
应该谨慎看待组间受试者脱落率不一致的试验,因为这可能意味着有信息的删失。如果实验组因药物耐受性差而出现较高的脱落率,并且一些患者在肿瘤进展被记录之前就被剔除,那么PFS就会在那些对药物耐受性较好的患者和患者数更多的对照组之间进行比较。因此,无进展患者/有风险患者比值的估计值就会存在偏倚,并且会违背意向性分析(ITT)原则。
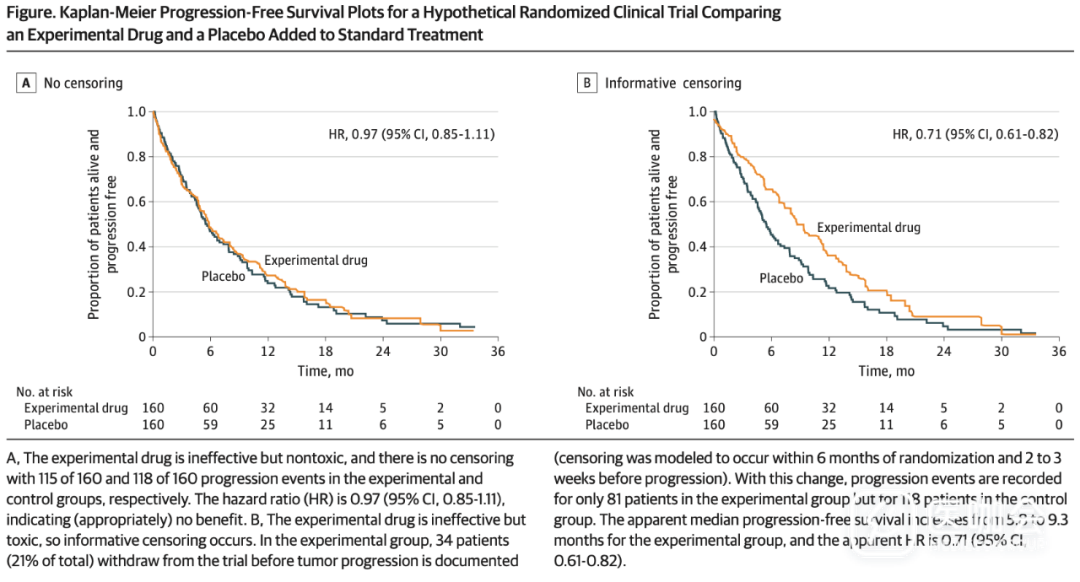
下图展示了这种信息删失是如何产生偏差的。下图假设了一项临床试验,比较了标准治疗+一种无效且无毒性药物 vs 标准治疗+安慰剂的疗效。图A假设没有发生信息删失,两组的PFS曲线相似。在图B中,假设这个无效药物存在毒性,从而使实验组34名(34/160,21%)患者在记录病情进展前就被剔除。在这个例子中,剔除导致了曲线的分离,实验组的HR为0.71(95%CI,0.61-0.82),表明实验组的疗效更好。未考虑到信息删失会导致偏差,甚至可能导致无效但有毒的药物成功注册上市。
图. Kaplan-Meier PFS曲线
更长的PFS会转化为OS和/或QoL的获益吗?
一项在雌激素受体阳性晚期乳腺癌女性中进行的试验,说明了组间不均衡的脱落率影响了组间PFS的差异,是否能转化为OS的改善。BOLERO-2(乳腺癌患者口服依维莫司试验-2)研究比较了绝经后女性使用依西美坦+依维莫司 vs 依西美坦+安慰剂的疗效[2]。研究者报告了PFS这一主要终点的显著改善,HR为0.43(95%CI,0.35-0.54)。
依维莫司具有毒性,实验组和对照组分别有24%和6%的女性因不良事件而停止治疗。一些停止治疗的女性被随访至肿瘤进展,但实验组的删失更多。随后的分析结果显示,在OS方面没有显著差异。
评估内分泌治疗的临床试验,针对耐受性更好的CDK4/6抑制剂帕博西尼或瑞博西尼的内分泌治疗试验中,均报告了PFS的改善,HR值在0.42(95% CI,0.32-0.56)至0.59(95% CI,0.48-0.73)之间,组间的脱落率差异很小。这些药物也带来了OS的统计学显著性改善或显示出改善趋势。[3]。
毒性药物的额外影响会阻止PFS的明显差异转化为OS的差异。在SOLAR-1(阿培利司在乳腺癌中的临床研究1)试验中,患有乳腺癌的女性被随机分配接受氟维司群+阿培利司或氟维司群+安慰剂治疗。据报道,患有PIK3CA突变乳腺癌的女性在PFS方面有显著差异(HR,0.65[95%CI,0.50-0.85])[4]。
随后的分析结果显示,OS方面没有显著差异。实验组的3级和/或4级毒性更高,有34人(34/169,20%)停止了治疗,有22人(22/179,13%)停止使用安慰剂。信息删失可能是导致缺乏OS获益的原因,但尽管阿培利司具有抗肿瘤活性,毒性也可能降低了实验组的生存率。
QoL的分析结果表明,虽然数据有利于安慰剂组,但没有明显的差异。某些特定患者可能从阿培利司中受益,但基于试验的评估显示,OS或QoL没有改善,而且耐受性差。如果现实世界中的人群比试验参与者获益更少、毒性更大,就更需要深入评估了。
总结
FDA和EMA应该重新评估将PFS作为终点的临床试验的药物注册上市,期刊编辑和审稿人也应该认识到其潜在的影响。总生存期和/或有效的QoL指标是表明患者受益的最佳终点。对于预期有较长OS的患者,可以将PFS作为较早的初始终点,然而,应将脱落和肿瘤进展视为“事件”,从而评估治疗失败时间(TTF,由随机化开始至退出试验)。
尽管TTF终点已被FDA拒绝,而倾向于PFS,但它应该被重新评估。虽然TTF不是OS的替代指标,但它可以避免因脱落率不均而产生的误导性结论,而且不能耐受药物和肿瘤出现进展一样都是治疗无效的标志。药物批准的标准应该是药物在生存期或生存质量方面带来有意义的改善。虽然患者希望及时获得新的癌症治疗方法,但他们更希望研究人员能确定能提供真正获益的治疗方法。
参考文章:
1. JAMA Oncol. 2022 Mar 10.
doi: 10.1001/jamaoncol.2021.8206.
2. N Engl J Med. 2012;366(6):520-529.
doi:10.1056/NEJMoa1109653.
3. J Clin Oncol. 2018;36(24): 2465-2472.
doi:10.1200/JCO.2018.78.9909.
4. N Engl J Med. 2019;380(20):1929-1940.
doi:10. 1056/NEJMoa1813904.
更多阅读: