盘点:不要错过的降脂治疗研究进展
近期,Lancet上发表了一篇对结合IMPROVE-IT研究【依折麦布+他汀】数据进行的事后分析的文章,探讨了多血管疾病和T2DM各自对长期心血管风险的影响。今天就跟大家一起盘点一下关于降脂治疗的重要研究。
血脂治疗进展的timeline
从最初的NCEP的指南建议:二级预防<100mg/dl,一级预防<130mg/dl,随着发现强化他汀使LDL进一步降低,可以使心血管事件进一步减少。开始有人提出:是不是越低越好,指南对LDL-C的推荐也有较前进一步降低,但是到目前为止,仍然没有一个绝对的阈值。
LDL-C是不是越低越好,直觉告诉我们这个肯定是有问题的,老祖宗的智慧告诉我们,凡事都有个度,过犹不及。那么LDL-C到底是多低为好,另外太低了会不会带来其它安全性的问题,需不需要减药或停药。
接下来,我为大家盘点几项关于LDL-C治疗目标的重要研究。
IMPROVE-IT研究
近期,Lancet上发表了一篇对结合IMPROVE-IT研究【依折麦布+他汀】数据进行的事后分析的文章,探讨了多血管疾病和T2DM各自对长期心血管风险的影响。今天就跟大家一起盘点一下关于降脂治疗的重要研究。
血脂治疗进展的timeline
从最初的NCEP的指南建议:二级预防<100mg/dl,一级预防<130mg/dl,随着发现强化他汀使LDL进一步降低,可以使心血管事件进一步减少。开始有人提出:是不是越低越好,指南对LDL-C的推荐也有较前进一步降低,但是到目前为止,仍然没有一个绝对的阈值。
LDL-C是不是越低越好,直觉告诉我们这个肯定是有问题的,老祖宗的智慧告诉我们,凡事都有个度,过犹不及。那么LDL-C到底是多低为好,另外太低了会不会带来其它安全性的问题,需不需要减药或停药。
接下来,我为大家盘点几项关于LDL-C治疗目标的重要研究。
IMPROVE-IT研究
IMPROVE-IT研究是一个多中心,随机,双盲,阳性对照的试验研究。 旨在验证:相比单药他汀,他汀方案上增加依折麦布可以使ACS人群带来更多获益。
各组降脂终点:
- 辛伐他汀/依折麦布(中位数):53.7mg/dl(1.4mmol/L)
- 辛伐他汀(中位数):69.5mg/dl(1.8mmol/L)
主要终点的生存曲线:(HR 0.936 P=0.016)
- 联合组:32.7%
- 单药组:34.7%
研究结果显示:在他汀的基础上加用依折麦布可以进一步降低LDL-C【1.4mmol/L】,并改善心血管结局。即将LDL-C降至靶目标以下能有额外的获益。
然而极低水平的LDL-C会不会带来安全方面的问题还不得而知如果再进一步降低,是否安全,能否进一步降低心血管事件,仍然不得而知。
尽管如此,2017年AACE指南,还是作了跟进:对于极高危人群,LDL-C目标降至55mg/dl 【IMPROVE-IT中位数是53.4mg/dl】。
接下来是2017年3月发表在JAMA上的一篇文章,仍然是对IMPROVE-IT研究的进一步挖掘,文章标题就是:极低水平的LDL-C的长期安全性。
IMPROVE-IT研究-预先设定分析
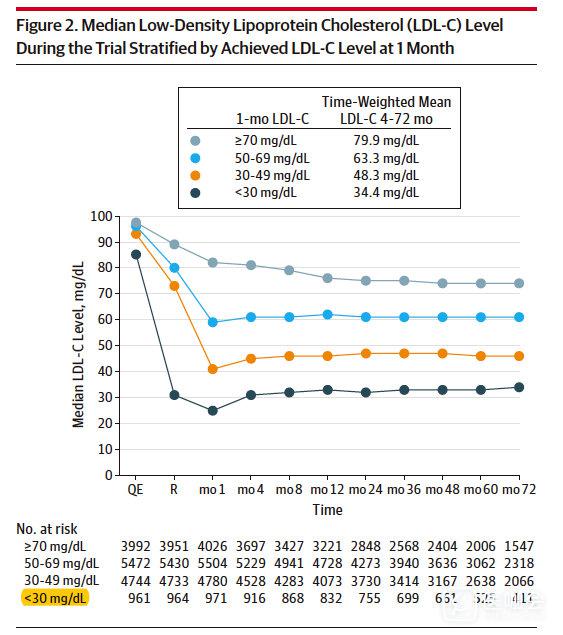
这篇文章的特点新颖之外在于不按干预种类分组来看,而是干预后的LDL-C水平进行分组。
下图是按照治疗1月后的血脂水平进行分层,然后观察患者血脂变化及研究终点,结果发现各组人群的安全谱与LDL-C相对较高的人群相似。
主要复合终点:P for trend < 0.001;
- >70mg/dL:HRs of 1.0
- 50-69mg/dL:HRs of 0.82
- 30-49mg/dL:HRs of 0.80
- <30mg/dL:HRs of 0.79
我们看出:LDL-C<30mg/dl的心血管事件风险最低,但是这个研究并不能说明进一步降低LDL-C能够带来更大的获益,因为这个只是对数据的回顾性分析,分析时是以LDL-C进行分层的,并不是随机分组,所以每组人群的危险程度差异可能会很大,但证明了极低水平是安全的,但是能否带来进一步获益不得而知。
人们开始有了这样一个假设:
因为观察白人、穆斯林、亚洲人以及南美洲居民的血脂情况发现,即无论母亲的血脂水平多高,新生儿的 LDL-C 水平都在 35 mg/dl 左右。当时提出假设:由于新生儿是没有动脉粥样硬化的,将 LDL-C 水平降至新生儿水平是否就是合理水平呢?
接下来,我们来进一步说一说FOURIER研究,这个研究是2017年ACC心血管峰会的一个重磅研究。
FOURIER研究
Evolocumab一种PCSK9抑制剂,一种新型的降脂药。研究评估了Evolocumab在心血管疾病人群中的临床结局。
首先我们先说一下PCKS9是个什么东西,在循环中,LDL-C会与LDL-R受体结合,转运入细胞内,从而降低机体血脂,在细胞内LDL-R与LDL解离,LDL-R重新回到细胞膜。PCSK9也会与LDL-R受体结合,与LDL结合位点不同,不影响LDL-R将LDL转运入胞内,但是会使LDL-R降解,因此PCKS9会减少细胞膜LDL-R受体的降解,达到降脂的目的。
这个研究纳入了27564名血脂控制不达标有心血管疾病史的患者,分别给予PCSK9抑制剂,另外一组安慰剂对照。分别观察二组人群的心血管结局。
研究结果显示:在他汀的基础上,evolocumab,通过抑制PCSK9,可以使LDL-C降至30mg/dl水平,并减少心血管事件的发生率。以上数据提示:有动脉粥样硬化性心脏病的患者,将降至LDL-C降至目标值以下能够获益。
下图是对上述内容的一个总结:
接下来,为大家盘点2018年关于降脂的最新研究
JAMA:基线LDL-C水平对治疗结局的影响
研究纳入了34项随机临床研究,136 299名患者接受了高强度「more intensive」的降脂治疗,133 989名患者接受了低强度「less intensive」降脂治疗 (通常为对照组的降脂治疗)
研究结论显示:在基线LDL-C较高时,高强度降脂治疗研究中患者总死亡率和心血管死亡率的降低更明显。但是当基线LDL-C水平低于100mg / dL时,这种关联不存在,这表明LDL-C降低治疗可能对基线LDL-C水平较高的患者产生最大益处。
最后我们还是回到文章开头的那篇文章:
IMPROVE-IT研究事后分析
此项针对IMPROVE-IT研究的事后分析:评估了合并多血管疾病,2型糖尿病,以及二者共同对心血管风险的影响。
研究结果:
不同人群的主要结局发生率:
- 多灶性血管疾病+T2DM:60.0%
- T2DM:39.9%
- 多血管性疾病:39.8%
- 无血管性疾病和T2DM:29.6%
以上结果显示:T2DM和多灶性血管性疾病人群中发生心血管事件的风险相似。对于多灶性血管疾病人群,如合并T2DM,心血管风险显著增加HR 1.60 【1.38–1.85】
上图显示:不管是有无合并糖尿病或多灶性心血管疾病,强化降脂治疗组均能减少心血管事件的发生,尽管未达到统计学差异(可能与亚组分析的样本量有关)。但考虑到合并多灶性心血管疾病的T2DM发生心血管的风险是最高的,因此这部分患者给予强化降脂的获益应该是最大的。
扫码关注“医咖会”公众号,及时获取最新重磅研究!