2018专家共识:合并ASCVD的2型糖尿病患者的药物治疗
2型糖尿病的治疗理念从最早的「重视强化治疗」,过渡到「强调个体化治疗」,再到现在的「强调结局」,由于T2DM患者的死因主要是心血管疾病,所以所谓的「强调结局」主要是基于减少心血管事件。
这一理念的转变,主要是由于2008年罗格列酮「出事」后,尽管后来证实是个乌龙,但FDA自此之后开始对降糖药上市提出要求,即要满足心血管的安全性,因此才有了后续一系列心血管安全性研究。其中LEADER研究【利拉鲁肽】和EMPA-REG CVOT研究【恩格列净】二项研究为降糖理念的转变奠定了非常坚实的基础。
由于GLP-1受体激动剂和SGLT-2抑制剂在降低血糖的同时,能带来体重减轻,且低血糖风险低,最重要的是能带来心血管获益,所以目前二类药物的呼声越来越高,不仅是内分泌科大夫,更是受到心血管科大夫的关注。
2017年Defronzo教授亦是针对此主题连续发表多篇文章,可能是觉得一篇文章不足以抒发自己的情绪:先后有《2型糖尿病和心血管疾病:新时代要来了吗?》,《是时候改变糖尿病规范:GLP-1应取代二甲双胍》,《GLP-1受体激动剂联合SGLT-2抑制剂》等一系列文章。大咖就是大咖,发文章的速度比你看文章的速度还要快,都不给读者喘口气的机会。而且给人一种「事了拂衣去,深藏功与名」的世外高人的形象。
既然二者都能带来心血管获益,那么二类药物联合能否成为降糖药治疗的最佳CP? 从T2DM病理生理的角度来看(八重奏),二者的联合能覆盖几乎所有T2DM的病理生理异常。
尽管目前没有针对GLP-1受体激动剂联用SGLT-2抑制剂带来心血管获益证据的研究。但是从机制上讲,这二类类药物对胰高血糖素具有相反的作用,表明存在相互作用的可能性,并且有研究显示二者在降糖以外的一些获益有叠加作用,如血压和体重降低。而且使用SGLT2抑制剂和GLP-1RA进行血糖管理的联合治疗也符合当前的T2D管理指南【不同机制联合互补】。因此,同时使用SGLT2抑制剂和GLP-1RA同时显示出心血管获益似乎是合理的。
2型糖尿病的治疗理念从最早的「重视强化治疗」,过渡到「强调个体化治疗」,再到现在的「强调结局」,由于T2DM患者的死因主要是心血管疾病,所以所谓的「强调结局」主要是基于减少心血管事件。
这一理念的转变,主要是由于2008年罗格列酮「出事」后,尽管后来证实是个乌龙,但FDA自此之后开始对降糖药上市提出要求,即要满足心血管的安全性,因此才有了后续一系列心血管安全性研究。其中LEADER研究【利拉鲁肽】和EMPA-REG CVOT研究【恩格列净】二项研究为降糖理念的转变奠定了非常坚实的基础。
由于GLP-1受体激动剂和SGLT-2抑制剂在降低血糖的同时,能带来体重减轻,且低血糖风险低,最重要的是能带来心血管获益,所以目前二类药物的呼声越来越高,不仅是内分泌科大夫,更是受到心血管科大夫的关注。
2017年Defronzo教授亦是针对此主题连续发表多篇文章,可能是觉得一篇文章不足以抒发自己的情绪:先后有《2型糖尿病和心血管疾病:新时代要来了吗?》,《是时候改变糖尿病规范:GLP-1应取代二甲双胍》,《GLP-1受体激动剂联合SGLT-2抑制剂》等一系列文章。大咖就是大咖,发文章的速度比你看文章的速度还要快,都不给读者喘口气的机会。而且给人一种「事了拂衣去,深藏功与名」的世外高人的形象。
既然二者都能带来心血管获益,那么二类药物联合能否成为降糖药治疗的最佳CP? 从T2DM病理生理的角度来看(八重奏),二者的联合能覆盖几乎所有T2DM的病理生理异常。
尽管目前没有针对GLP-1受体激动剂联用SGLT-2抑制剂带来心血管获益证据的研究。但是从机制上讲,这二类类药物对胰高血糖素具有相反的作用,表明存在相互作用的可能性,并且有研究显示二者在降糖以外的一些获益有叠加作用,如血压和体重降低。而且使用SGLT2抑制剂和GLP-1RA进行血糖管理的联合治疗也符合当前的T2D管理指南【不同机制联合互补】。因此,同时使用SGLT2抑制剂和GLP-1RA同时显示出心血管获益似乎是合理的。
今天结合2018年《美国心血管专家共识:降低合并ASCVD的2型糖尿病患者的心血管风险》来梳理一下关于GLP-1受体激动剂和SGLT-2的心血管获益证据,以及注意事项。
全文链接:
http://www.onlinejacc.org/content/early/2018/11/29/j.jacc.2018.09.020
SGLT-2抑制剂
大规模随机对照临床研究显示:恩格列净和坎格列净能减少主要心血管事件发生率以及心衰住院率。而且恩格列净还显著降低了心血管和全因死亡率的风险。
SGLT2抑制剂:作用机制
SGLT2肾单位近端小管中的钠 - 葡萄糖协同转运蛋白,其负责约90%的尿葡萄糖重吸收。SGLT2抑制剂通过诱导糖尿,从而导致葡萄糖降低,这种效果在高血糖的情况下更明显,大量葡萄糖被过滤到尿液中,随着血糖趋于正常化,糖尿减少明显。
因此,服用SGLT2抑制剂的患者的低血糖风险非常低,除非它们与胰岛素或胰岛素促分泌剂(如磺酰脲类和格列奈类药物)联合使用时。除了对血糖的影响外,SGLT2抑制剂还会引起利尿和尿钠作用,体重减轻和收缩压降低。
SGLT2抑制剂:心血管获益
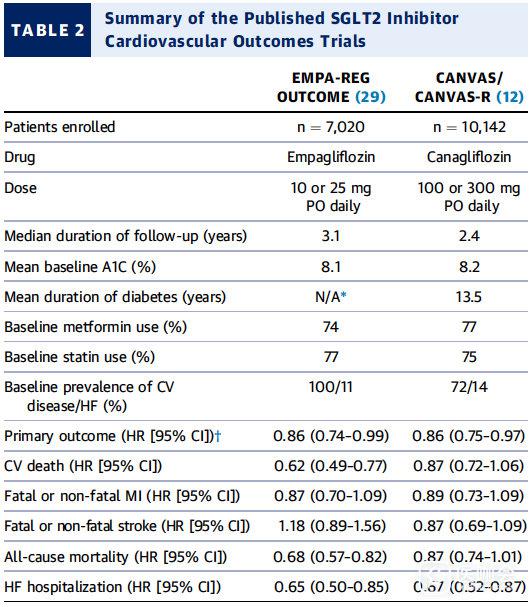
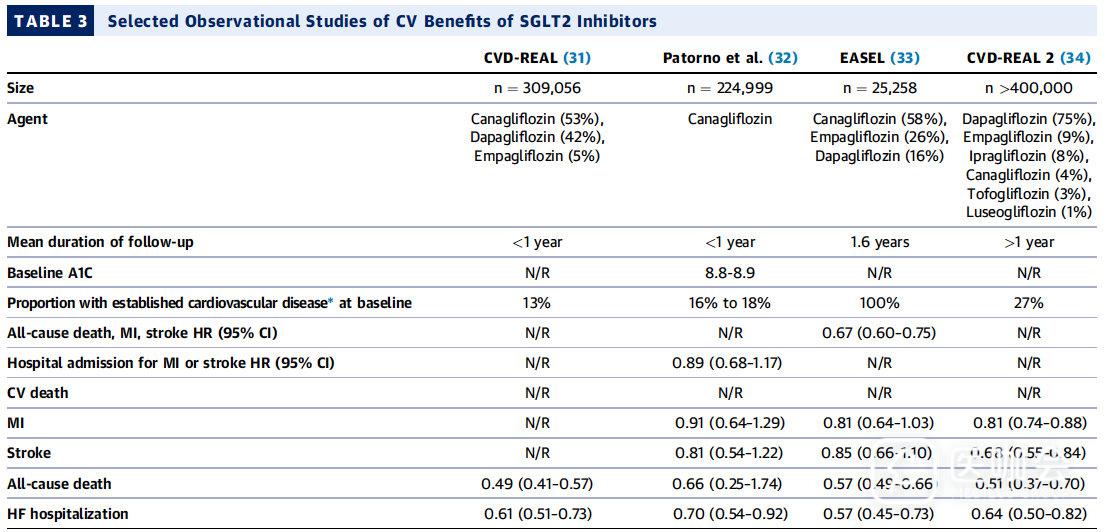
迄今为止,2项大型CVOT研究,即 EMPA-REG研究和 CANVAS研究(包括CANVAS和CANVAS-R),与安慰剂相比,随机接受SGLT2抑制剂治疗的患者的主要心血管事件显著降低【表2】。基于大型数据库的观察性研究报告亦显示了类似的临床获益【表3】。
表2. 已公布的SGLT2抑制剂CVOT数据总结
表3. SGLT2抑制剂心血管效益的观察性研究
1. EMPA-REG研究:恩格列净
- 与安慰剂相比,恩格列净组3P MACE的相对风险降低14%【HR:0.86; 95%CI:0.74-0.99】。以及观察到的全因死亡率降低32%【HR:0.68; 95%CI:0.57至0.82】,主要是由于CV死亡减少38%【HR:0.62; 95%CI:0.49-0.77)。
- 对致死性或非致死性心梗的影响较为温和【HR:0.87; 95%CI:0.70~1.09】。
- 有人提出致死性或非致死性卒中风险增加【HR1.18 95%CI:0.89-1.56】,因为置信区间明显超过1。
- 重要的是,HF住院的次要终点减少了35%【HR:0.65; 95%CI:0.50至0.85】。
- 累积事件曲线的分离表明药物早期获益并且在根据研究开始时有无HF进行的亚组分析结果是一致的。
迄今为止,恩格列净是目前FDA唯一批准用于降低合并CVD的T2DM患者心血管风险的一种SGLT2抑制剂。
2. CANVAS研究:坎格列净
CANVAS研究包括:CANVAS和CANVAS-R二项研究,分别招募了4,330名和5,812名患者,其中72%合并动脉粥样硬化性心血管疾病(ASCVD)。CANVAS和CANVAS-R的结果大部分与EMPA-REG OUTCOME的结果一致。
- 与安慰剂相比,坎格列净对心血管和全因死亡的影响虽然效能不足,但与主要终点的方向一致。
- 与EMPA-REG结果一样,SGLT2抑制剂剂量之间没有结果差异。
CANVAS/CANVAS-R联合分析显示,与安慰剂相比,主要结局相对风险减少14%【HR:0.86; 95%CI:0.75-0.97】,各组分的风险始终有利于SGLT2抑制剂治疗:
- 心血管死亡【HR:0.87; 95%CI:0.72-1.06】
- 致死性或非致死性MI【HR:0.89; 95%CI:0.73-1.09】
- 致死性或非致死性卒中【HR:0.87; 95%CI:0.69-1.09】
- 全因死亡率风险【HR:0.87; 95%CI:0.74-1.01】。
CANVAS研究中的探索性结果:HF住院次要终点显著减少33%【HR:0.67; 95%CI:0.52至0.87】,类似于EMPA-REG OUTCOME的结果。
SGLT2抑制剂达格列净和埃格列净以及SGLT2和SGLT1抑制剂sotagliflozin的前瞻性CVOT研究目前正在进行中。
3. 大型数据库的观察性研究:结果基本一致。【表3】
CVD-REAL研究中:
- 与接受其他口服T2D药物的队列相比,接受SGLT2抑制剂的患者全因死亡风险下降51%【HR:0.49; 95%CI:0.41~0.57】
- HF住院治疗风险降低39%【HR:0.61; 95%CI:0.51~0.73】
CVD-REAL 2研究中【人群样本量更大】:
- 全因死亡风险降低49%
- HF住院风险降低36%
- MI和卒中风险降低
尽管这些观察性研究数据具有局限性,尽管使用了严格的的统计手段,但仍可能高估了这些药物的有效性。尽管如此,来自严格控制的临床试验环境之外的这些真实世界的观察性研究结果为这类药物的CV获益提供了进一步的支持。
SGLT2抑制剂:心血管以外的获益
恩格列净和坎格列净对肾脏均具有良好的保护作用。
1. EMPA-REG OUTCOME研究:减缓了肾脏疾病的进展
- 减少了肾病的发生或恶化(定义:大量白蛋白尿的进展)【HR:0.61,95%CI:0.53-0.70】。
- 可能的机制包括:管球反馈,肾小球高压的降低,超滤损伤的控制以及对钠 - 氢交换的影响。
2. CANVAS和CANVAS-R研究
- 白蛋白尿的进展发生风险较小【HR:0.73; 95%CI:0.67-0.79】
- 白蛋白尿的消退发生率更高【HR:1.70; 95%CI:1.51至1.91】
- CANVAS的肾脏复合结局降低40%(定义:eGFR降低,肾脏替代治疗,肾脏病死亡),但是否是由其中的一项,二项或三项均下降研究中并未报道。
SGLT2抑制剂:安全问题
表4. SGLT2抑制剂的禁忌症和安全性问题
SGLT2抑制剂患者生殖器真菌感染的风险增加【女性多为念珠菌性阴道炎,男性龟头炎】,但这些感染通常不严重,往往可以通过短期抗真菌药物来解决,很少再次发生。
尽管接受SGLT2抑制剂治疗患者有肾盂肾炎和尿脓毒症的上市后报告,但大型临床试验显示:SGLT2抑制剂与安慰剂之间的任何尿路感染率或严重尿路感染率并无差异。
有关于会阴坏死性筋膜炎的罕见上市后报告(注:5年内12例,2017年有超过170万患者接受SGLT2抑制剂治疗),因此导致FDA要求在SGLT2抑制剂说明书上进行说明,但尚不清楚这些感染是否与SGLT2抑制剂的使用有因果关系。
有病例报告显示,在没有显著高血糖的情况下,SGLT2抑制剂导致糖尿病酮症酸中毒的风险增加,称为“血糖正常型酮症酸中毒”。但在T2D患者的大型随机对照试验中显示,这种风险非常低,特别是那些不需要胰岛素治疗的患者。对于有酮症酸中毒症状或体征的患者,如呼吸困难,恶心,呕吐和腹痛,应停用SGLT2抑制剂并立即就医。医生应该意识到导致这种状况促发因素和治疗策略的因素。
研究显示坎格列净与下肢截肢风险增加有关【中位随访126周后观察患者截肢率,6.3 VS 3.4/1,000人年,p <0.001】,这促使FDA2017年5月在坎格列净的说明书上增加了增加黑框警告。另外埃格列净【ertugliflozin】在说明书中也报告了III期试验中截肢的数据:安慰剂 0.1%【n = 1】与15 mg埃格列净 0.5%【n = 8】。但是到目前为止,恩格列净或达格列净的研究中并未观察到这种风险。因此截肢风险是否为类效应尚不清楚,但有截肢史,外周动脉疾病,周围神经病变或糖尿病足溃疡史的患者应警惕。
在CANVAS研究中观察到使用坎格列净的患者骨折发生风险相对更高,但在CANVAS-R试验中并没有观察到上述现象。
鉴于利尿和抗高血压作用,SGLT2抑制剂可能导致血容量减少和低血压的风险; 在大型随机对照试验中,坎格列净的风险略高于安慰剂,但使用恩格列净时并没有增加。
虽然SGLT2抑制剂对急性肾损伤有早期潜在的担忧,但迄今为止,在大型随机对照试验中尚未观察到这些风险。目前FDA针对此的建议是在急性肾损伤或肾功能损害的情况下应停止治疗; 这有待在肾功能不全患者中的安全性和有效性的前瞻性研究结果。
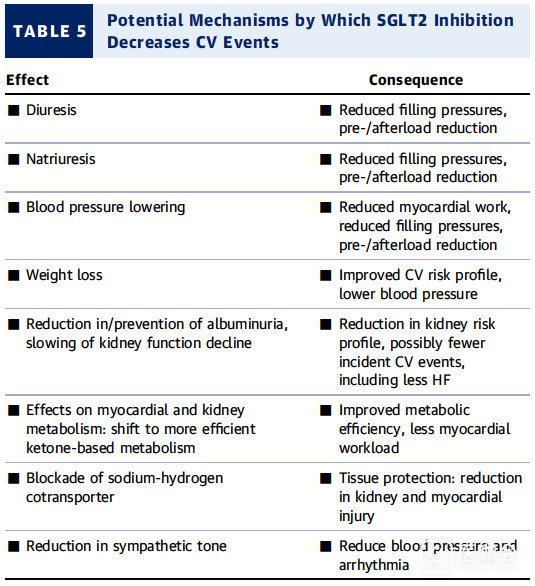
SGLT2抑制剂的心血管获益可能机制【表5】
SGLT2抑制剂的CV益处可能机制:
- 利尿,利钠,体重减轻和血压降低。
- 对交感神经系统的影响,以及对钠 - 氢交换的抑制,可能减少心脏损伤,肥大,纤维化,重塑和收缩功能障碍。
- 使心肌代谢从游离脂肪酸和葡萄糖氧化转向对能量利用更有利的酮体(这可能会提高心肌功效和功能)。
表5. SGLT2抑制剂减少心血管事件的潜在机制
GLP-1受体激动剂
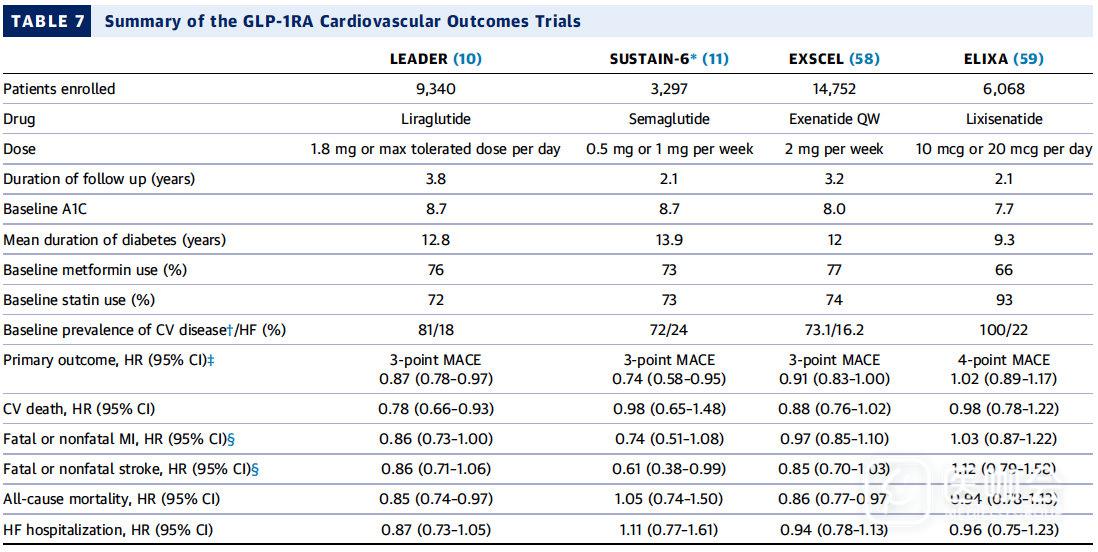
- 在FDA批准的6种GLP-1RAs中,迄今为止只有利拉鲁肽明确证实可以显著降低CV事件。
- 索马鲁肽在其非劣效性设计的中等大小的研究中,观察到类似的获益。【参见表7】
- 与安慰剂相比,艾塞那肽周制剂的3PMACE结局在数值显示优势倾向,然而并没有达到统计学差异。
- 利西拉来似乎并不会降低发生过急性冠脉综合征后患者ASCVD事件的风险。
总之,这些结果表明GLP-1受体激动剂这一类药物的心血管获益存在药物异质性的可能性,尽管药物的剂量或特定药物特点,或者由于患者群体和试验设计之间的差异也是产生这种获益差异的原因。
表7. GLP-1RA心血管结局试验总结
GLP-1受体激动剂的作用机制
GLP-1是进食后回肠末端和结肠释放的一种多肽类激素。给予GLP-1RA后,超生理浓度的GLP-1通过增加葡萄糖依赖性胰岛素分泌和降低胰高血糖素分泌,以及通过延迟胃排空来增加饱腹感,最终降低血糖。
GLP-1受体激动剂:心血管获益
1. LEADER研究【利拉鲁肽】:研究招募9,340例T2DM患者【81% 合并ASCVD,19%老年糖尿病】,随机分为利拉鲁肽或安慰剂组。
- 3P MACE复合终点减少了 13%【HR:0.87; 95%CI:0.78-0.97;优效,p = 0.01】。各组分都有助于降低心血管获益证据。
- 全因死亡率降低15%【HR:0.85; 95%CI:0.74-0.97 p = 0.02】。全因死亡率的降低主要是由于CV死亡率下降所致。
- LEADER研究并未发现心衰住院事件的减少【HR:0.87; 95%CI:0.73-1.05; p = 0.14】。
迄今为止,利拉鲁肽是FDA批准的唯一用于降低合并心血管疾病的T2DM的主要心血管事件的一种GLP-1RA。
2. SUSTAIN-6研究【索马鲁肽】:使用与LEADER相同的试验入选标准招募了3,297名患者,并具有相同的主要复合终点。
- 3P MACE复合终点风险下降26%【HR:0.74; 95%CI:0.58至0.95】
- 非致命性卒中的风险下降:【HR 0.61; 95%CI:0.38-0.99】
- 非致死性心梗呈下降趋势 【HR:0.74; 95%CI:0.51-1.08】
- 未观察到全因死亡率下降【HR:1.05; 95%CI:0.74至1.50】
- 未观察到 心血管死亡率下降(HR:0.98; 95%CI:0.65至1.48)
- 未观察到HF事件的减少
口服索马鲁肽的心血管研究目前处于研究中【NCT02692716】
3. EXSCEL研究【艾塞那肽】:研究招募14,752名T2DM【70%合并ASCVD】,与安慰剂相比,艾塞那肽的3P MACE复合终点呈现降低趋势,但并没有达到统计学意义【HR:0.91, 95%CI:0.83-1.00】。
- 全因死亡率较低【HR:0.86, 95%CI:0.77-0.97】
- 心血管死亡率的呈下降趋势【HR:0.88, 95%CI:0.76 to 1.02】
- 心衰住院治疗没有差异。
4. ELIXA研究【利西拉来】:研究招募了6,068名发生了急性冠状动脉综合征的患者,结果并未显示出4PMACE复合结局的获益的证据【CV死亡,非致死性心肌梗死,非致死性卒中或因不稳定性心绞痛住院治疗】,或者复合终点各组分以及心衰住院风险的下降。
5. 两项II期试验:检测了利拉鲁肽是否可以改善心力衰竭的预后。
- FIGHT试验【n = 300】:治疗组的主要终点并无差异【死亡,心衰住院治疗时间或NT-proBNP浓度的时均比例变化的等级评分】
- LIVE试验【n = 243】:检查了利拉鲁肽在射血分数降低的患者中的应用。结果发现主要终点【左心室射血分数】并没有差异,但在治疗组中严重心血管事件的发生率更高【12事件 VS 3 事件 p = 0.04】
6. 正在进行的研究:
正在进行的其他GLP-1RA心血管预后试验可以进一步阐明这类药物对心力衰竭患者是否安全有效。
GLP-1RAs:非心血管获益
1. 虽然尚未在独立的随机对照试验中得到证实,但现有试验的分析表明GLP-1RAs可能提供肾脏益处。
- LEADER研究:无论基线eGFR如何,利拉鲁肽与肾脏复合终点下降20%有关【定义:新发持续性大量白蛋白尿,肌酐水平翻倍,终末期肾病或肾病引起的死亡】。该结果主要是由于持续性大量白蛋白尿减少26%。
- SUSTAIN-6中研究:索马鲁肽与复合终点下降46%有关【持续性大量白蛋白尿风险降低,肌酐加倍并伴有eGFR≤45mL/ min / 1.73 m2,或需要连续肾脏替代治疗】,这种获益主要是由白蛋白尿的减少驱动。
2. 使用GLP-1RA治疗可能会出现体重减轻,利拉鲁肽和艾塞那肽可降低总体重的2-4%,索马鲁肽甚至高于10%,尽管剂量通常高于CV风险降低的剂量。
3. 无论是由于体重减轻还是存在其他机制,GLP-1RAs也可以适度使血压降低,并使心率升高。
4. 与安慰剂(加常规治疗)相比,利拉鲁肽的使用使确认的低血糖发生率减少20%,严重低血糖减少31%。
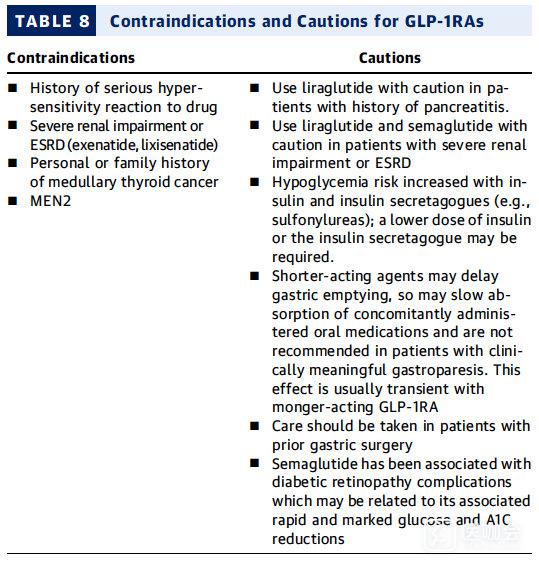
表8. GLP-1RAs的禁忌症和安全性问题
GLP-1RAs:安全问题
最常报告的GLP-1RAs副作用是恶心和呕吐。对于长效GLP-1RAs,这些胃肠道症状通常是短暂的,并且可以通过逐渐增加剂量以及教育患者减少进餐量来缓解。
GLP-1RAs也可能增加胆囊疾病的风险,包括急性胆囊炎。由于短效GLP-1RAs延迟胃排空,同时口服药物的吸收可能会受到影响,尽管这一理论上的临床相关性仍不清楚。曾进行过胃手术的患者应谨慎使用。
GLP-1RAs可导致心率升高。
GLP-1RAs本身不太可能引起低血糖症,但当它们与胰岛素或胰岛素促分泌素 - 最常见的磺脲类药物联合使用时,可能会出现低血糖。
尽管上市后病例报告表明GLP-1RAs与急性胰腺炎之间存在可能的联系,但LEADER研究中未发现胰腺炎风险增加。此外,FDA和欧洲药品管理局并未认定此类药物与胰腺炎或胰腺癌之间的因果关系。
对于严重肾功能不全或终末期肾病患者,应谨慎使用利拉鲁肽和索马鲁肽。
在SUSTAIN-6试验中,索马鲁肽与糖尿病视网膜病变的增加相关,这种效应被认为可能与其在快速降低血糖和A1C方面的功效有关。因此,应建议患者在开始治疗前接受适当的,指南推荐的眼科检查。
GLP-1RAs的CV优势的假设机制
GLP-1RAs实现阳性CV效应的机制尚未完全阐明【见表9】。有研究已显示GLP-1RAs可使收缩压降低1至6 mm Hg,并使低密度脂蛋白胆固醇降低16%。有时GLP-1RA治疗带来的显著体重减轻也可能有助于解释其益处;然而,综合起来,这些影响不足以完全解释观察到的CV益处。GLP-1受体也存在于心肌和脉管系统中,但这些受体在观察到的心血管益处中的作用尚不清楚。
表9. GLP-1RA降低CV事件的可能机制
表10. 在二甲双胍治疗背景下使用GLP-1受体激动剂或SGLT-2抑制剂的时机
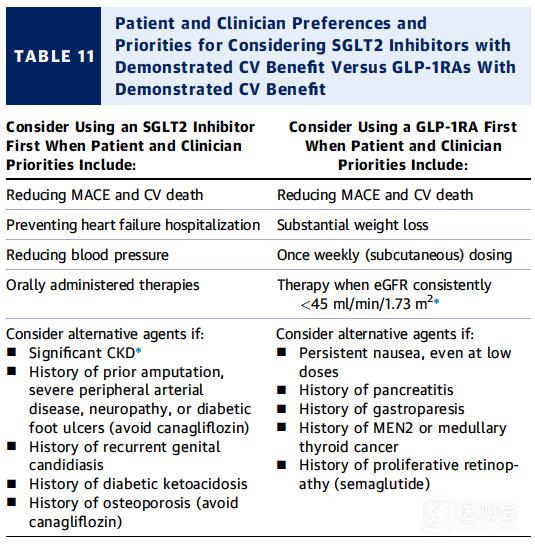
表11. 选择SGLT2抑制剂或GLP-1RA时需要考虑的偏好
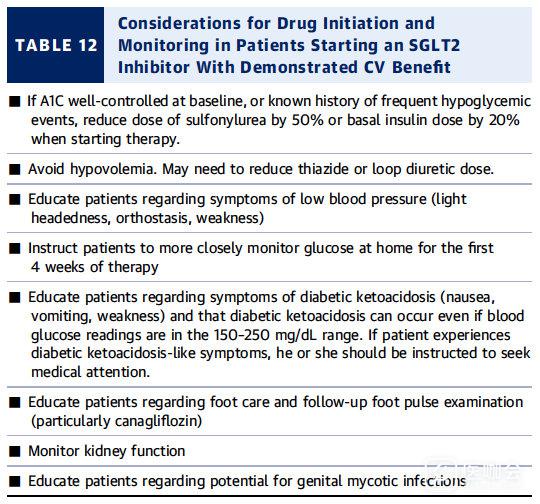
表12. 使用SGLT2抑制剂的注意事项
表13. 使用GLP-1RA的注意事项
SGLT2抑制剂和GLP-1RA是否应同时使用?
迄今为止,目前尚且没有针对GLP-1受体激动剂联用SGLT-2抑制剂带来心血管获益证据的研究。从机制上讲,这二类类药物对胰高血糖素具有相反的作用,表明存在相互作用的可能性,并且两类药物的自费成本可能非常高。
然而,DURATION-8【一项28周,多中心,双盲,3期,随机对照试验】显示艾塞那肽+达格列净,能更大的减少患者的血压和体重【相比二者单用】。这些数据表明,药物的血糖之外的作用可能是累加的。使用SGLT2抑制剂和GLP-1RA进行血糖管理的联合治疗也符合当前的T2D管理指南【不同机制联合互补】。因此,同时使用SGLT2抑制剂和GLP-1RA同时显示出心血管获益似乎是合理的,即使这种联合治疗尚未研究CVD风险降低。
未解决的问题
关于使用SGLT2抑制剂和GLP-1RA的几个重要临床问题仍未得到解决。
首先,显示SGLT2抑制剂和GLP-1RAs的心血管获益证据的研究中,大部分受试者在基线时接受了二甲双胍治疗。因此在启动二甲双胍之前启动SGLT2抑制剂和具有CV益处的GLP-1RA是否会导致心血管风险降低尚不清楚。然而,在EMPA-REG OUTCOME和LEADER试验中,没有证据表明恩格列净或利拉鲁肽的作用受到基线用药(包括二甲双胍)的影响 。
其次,显示SGLT2抑制剂和GLP-1RA获益证据的研究中,大多数患者的基线A1C≥7%(平均A1C高于8%)。因此,这些药物对T2D和A1C <7%患者的心血管益处尚未得到证实,尽管来自EMPA-REG OUTCOME试验的二次分析表明,恩格列净的心血管益处可能与试验期间HbA1C变化无关。
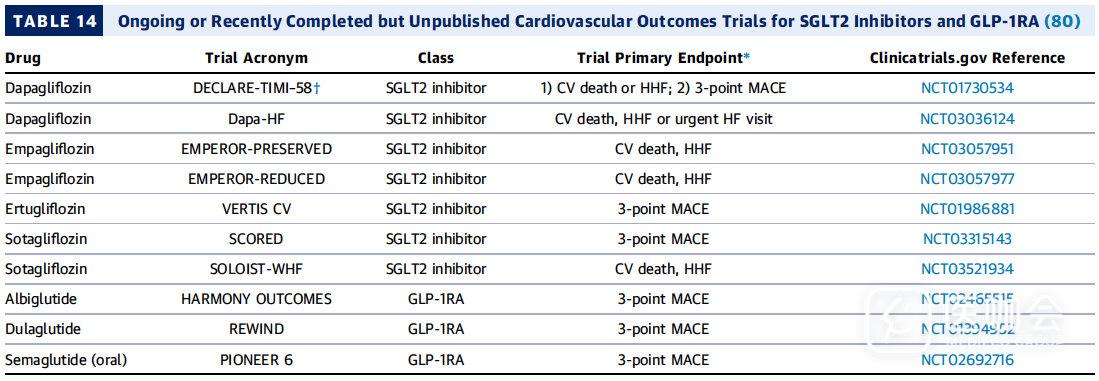
大部的CVOT的研究都集中在高危人群,目前正在进行的一些CVOT研究并正在寻求在更广泛人群中使用SGLT2抑制剂和GLP-1受体激动剂的使用【表14 包括心衰和慢性肾病】
表14. 正在进行或最近完成但尚未发表的SGLT2抑制剂和GLP-1RA的心血管结果试验
共识全文链接:
http://www.onlinejacc.org/content/early/2018/11/29/j.jacc.2018.09.020
有需要全文的,请点击页面右上方“下载资料”直接下载共识全文!