超全总结:1型糖尿病患者合并乳糜泻的诊疗
中国研究型医院学会糖尿病学专业委员会联合医咖会推出:研医论道。针对糖尿病领域的指南、最新文献、会议资讯,学会专家深度解读,全方位剖析领域热点!第16期由南京医科大学附属逸夫医院(第三附属医院)的刘煜教授带来『1型糖尿病患者合并乳糜泻』的精彩综述。
乳糜泻(Coeliac Disease,CD)和1型糖尿病(Type 1 Diabetes Mellitus,T1DM)是最常见的儿科自身免疫性疾病,近年来二者发病率均有所增加且常以共患形式存在。它们具有许多共同的遗传和免疫学特征,但在世界范围内其诊断和治疗方法却存在显著差异。由于T1DM儿童共患CD常较隐蔽,所以许多患儿仅在筛查时才被确诊CD。
本文总结了T1DM和CD的诊断及治疗方案,并着重强调了二者共患的情况;此外,权衡了CD筛查的利弊,并且提出了CD与T1DM共患时膳食治疗所面临的挑战;最后,介绍了二者遗传和致病机制研究的最新进展及一些前瞻性观点。
一、前言
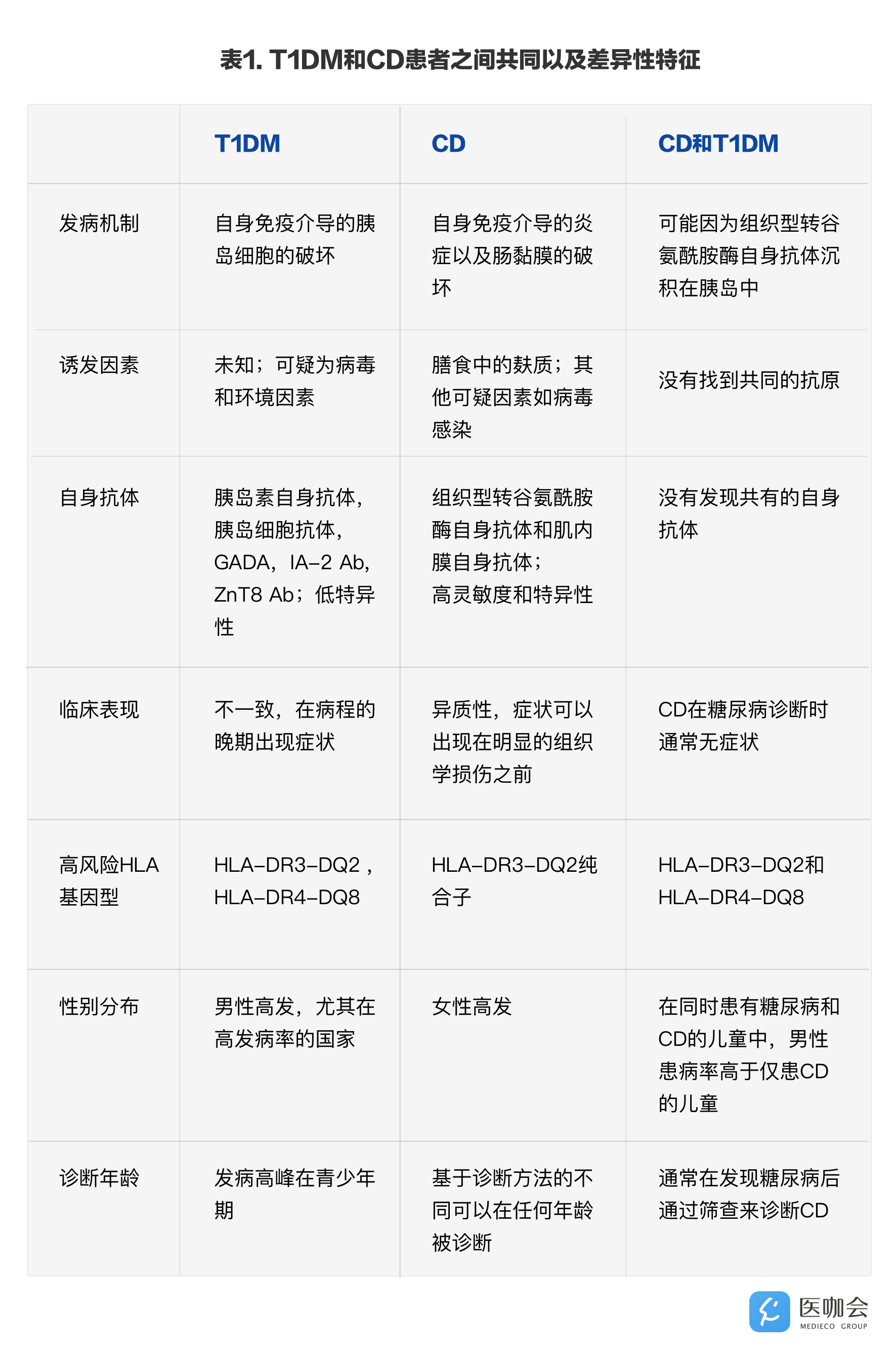
CD和T1DM是两种具有许多共同特征的自身免疫性疾病(表1)。需要特别指出的是,这两种疾病具有共同的遗传危险因素,因此同时患有这两种疾病的机会显著高于因偶然因素所致的共患。与许多自身免疫性疾病类似,这两种疾病都是遗传易感和环境因素共同作用的结果。
CD的致病抗原现已确定为膳食麸质,其为CD发展的必要条件,因此膳食中去除麸质后可修复该抗原所介导的肠道损伤。与CD不同,T1DM的触发抗原仍未知,一旦发病,其病情进展便不可逆转。这两种疾病共患预示着患者易发生严重的长期并发症。虽然目前的治疗手段,包括给予CD患者无麸质膳食以及给予T1DM患者多种胰岛素类似物控制血糖等是有效的,但这仍给受累患者的日常生活带来了极大地限制。
中国研究型医院学会糖尿病学专业委员会联合医咖会推出:研医论道。针对糖尿病领域的指南、最新文献、会议资讯,学会专家深度解读,全方位剖析领域热点!第16期由南京医科大学附属逸夫医院(第三附属医院)的刘煜教授带来『1型糖尿病患者合并乳糜泻』的精彩综述。
乳糜泻(Coeliac Disease,CD)和1型糖尿病(Type 1 Diabetes Mellitus,T1DM)是最常见的儿科自身免疫性疾病,近年来二者发病率均有所增加且常以共患形式存在。它们具有许多共同的遗传和免疫学特征,但在世界范围内其诊断和治疗方法却存在显著差异。由于T1DM儿童共患CD常较隐蔽,所以许多患儿仅在筛查时才被确诊CD。
本文总结了T1DM和CD的诊断及治疗方案,并着重强调了二者共患的情况;此外,权衡了CD筛查的利弊,并且提出了CD与T1DM共患时膳食治疗所面临的挑战;最后,介绍了二者遗传和致病机制研究的最新进展及一些前瞻性观点。
一、前言
CD和T1DM是两种具有许多共同特征的自身免疫性疾病(表1)。需要特别指出的是,这两种疾病具有共同的遗传危险因素,因此同时患有这两种疾病的机会显著高于因偶然因素所致的共患。与许多自身免疫性疾病类似,这两种疾病都是遗传易感和环境因素共同作用的结果。
CD的致病抗原现已确定为膳食麸质,其为CD发展的必要条件,因此膳食中去除麸质后可修复该抗原所介导的肠道损伤。与CD不同,T1DM的触发抗原仍未知,一旦发病,其病情进展便不可逆转。这两种疾病共患预示着患者易发生严重的长期并发症。虽然目前的治疗手段,包括给予CD患者无麸质膳食以及给予T1DM患者多种胰岛素类似物控制血糖等是有效的,但这仍给受累患者的日常生活带来了极大地限制。
现代研究增加了对这两种疾病的认识,特别是纵向前瞻性出生队列研究已经使得人们能够在疾病进展至临床诊断前较长时间对其发生发展进行探究。然而,几个亟待解决的问题依然存在。例如,疾病出现的确切时间以及是否所有的T1DM患者都应进行CD筛查等。此外,需要发现更多的环境诱发因素为新型治疗及预防策略的开发提供更多的可能。
作为治疗CD和/或T1DM患儿以及可疑患儿的医生,应熟悉这些疾病的临床表现和诊治策略的最新研究进展。同时,应该认识到在治疗期间可能出现的急性事件和长期并发症。故本文将对T1DM和CD共患的临床治疗方案进行讨论。同时,也对这两种身免疫疾病背后的致病机制及遗传学特征进行简要介绍。
二、流行病学
在过去的几十年里,CD和T1DM的发病率均迅速上升。例如,芬兰儿童T1DM的发病率从1980年到2011年增加了五倍,同时,CD的发病率呈现出与T1DM平行变化的规律。然而,这些疾病发病率的急剧上升可能会开始趋于平稳,目前至少在发达国家表现出该特点,但具体原因尚不清楚。
总体来说,CD的患病率稳定在1-2%左右,尤其是在起源于北欧和西欧的人群中。其在北非、中东和印度的一些地区也很常见;但在日本却非常罕见,而来自其他东亚国家的数据很少。T1DM在斯堪的纳维亚、撒丁岛,英国,加拿大和新西兰很常见,但在中国和委内瑞拉却相对少见。
这两种疾病的发病经常集中在同一地理学区域,但仅为部分重叠。值得注意的是,两种疾病似乎在发达国家更为常见;然而,由于CD临床表现的异质性以及医生对该疾病相关知识的缺失导致了显著的漏诊情况,所以需慎重的理解上述现象。我国CD的相关病例报道和流行病学数据相对较少,而实际上越来越多的证据显示,我国乳糜泻的患病率比实际想象的高。
作为另一种自身免疫性疾病,CD已被证实与T1DM存在紧密的联系。美国一项研究显示T1DM患者中,5%~10% 存在tTGA阳性,这些tTGA阳性的患者小肠黏膜活检异常高达75%。我们课题组的前期研究发现新发T1DM患者血清中tTGA阳性率高达19.2%,显著高于健康对照组,且未成年T1DM患者tTGA阳性率显著高于成年T1DM患者。
T1DM和CD亲属中T1DM及CD发病率也非常高。CD患者的生物学家庭成员患CD的风险较一般人群平均高2-10倍,而T1DM患者的生物学家庭成员患T1DM的风险较一般人群可高达15倍。此外,易患T1DM和CD的其他高危人群还包括21三体(唐氏综合症)和特纳综合征。
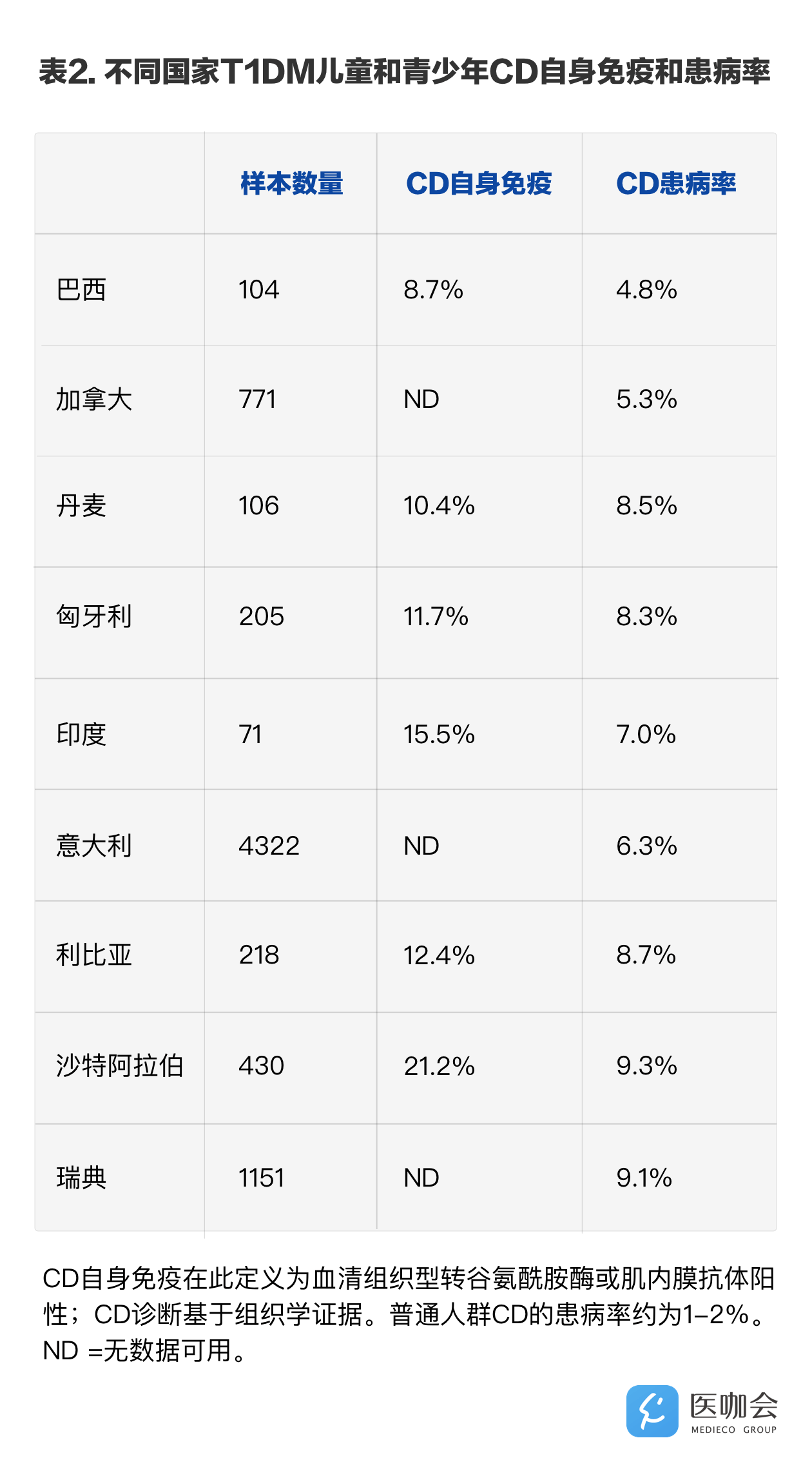
迄今为止,几乎所有的研究都发现T1DM患者中CD的发病率高于一般人群发病率(1-2%)(见表2),并且同样CD患者患T1DM的风险也是增加的。此外,患这两种疾病之一或者两病共患的儿童其他自身免疫性疾病的发病风险也是增加的,其中甲状腺相关疾病最为常见,其他已知的还包括爱迪生氏病、垂体炎以及系统性红斑狼疮。
T1DM的发病高峰为青春期早期,而CD则可出现在任何年龄。此外,CD在女性中的患病率是男性的2倍,而T1DM则表现为男性患病率更高,尤其是在高发病率的国家更为显著。T1DM与CD共患儿童的诊断年龄和性别分布受CD诊断方法的影响很大,而不同国家和地区CD诊断方法是有差异的。CD与T1DM的共存似乎增加了男性的比例,使得两病共患儿的性别比例更接近1:1。
三、CD和T1DM的发病机制
CD是在遗传易感人群中,由麦醇溶蛋白肽穿透肠上皮激活天然及获得性免疫而触发的。在此之前可能存在感染等触发的初始损伤,从而导致肠上皮屏障通透性增加。目前对麸质不耐受而导致对组织型转谷氨酰胺酶发生自身免疫反应的机制尚不明了,但普遍认为细胞介导的针对麦醇溶蛋白的免疫应答可能是其中的机制。
此过程中的一个独特现象是麦醇溶蛋白通过组织谷氨酰胺酶作用脱酰胺后,增加了其对抗原呈递细胞的亲和力,从而激活获得性免疫系统以及促炎性细胞因子的产生,引起肠上皮内淋巴细胞的浸润。疾病的最终阶段表现为绒毛萎缩和隐窝肠黏膜增生(图1)。
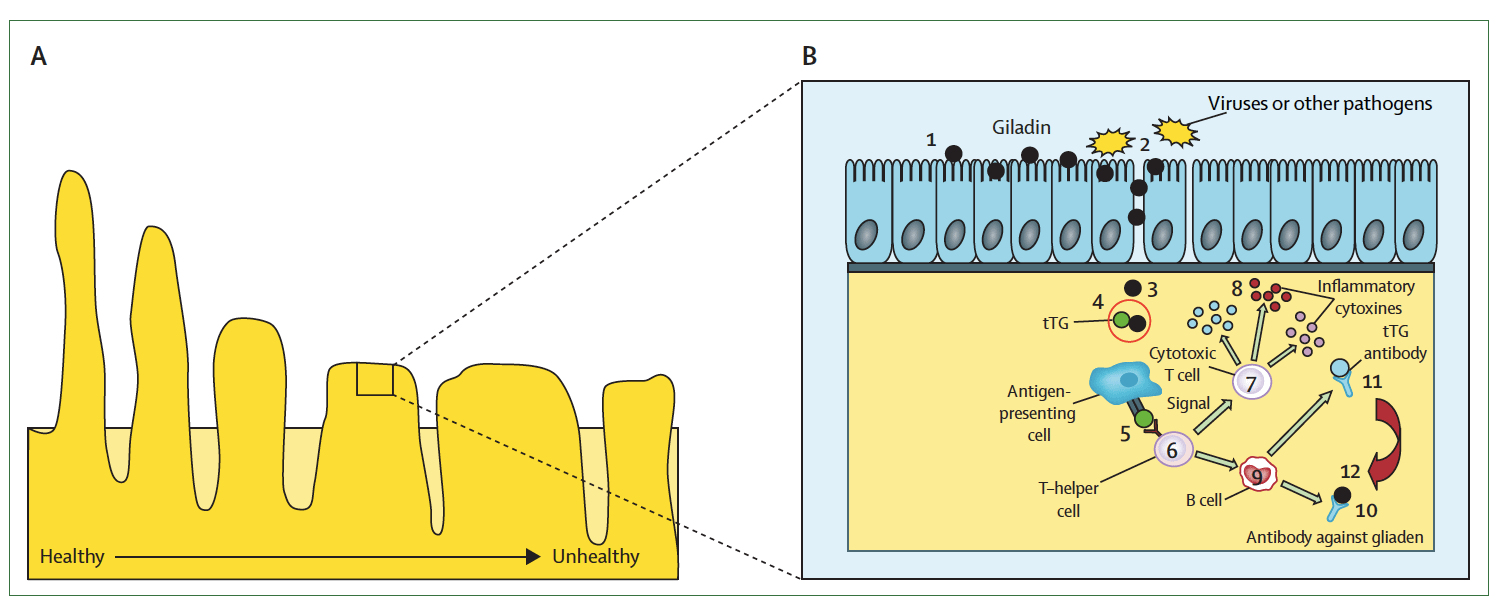
图1. 乳糜泻肠黏膜和细胞的逐渐破坏
(A)从健康的肠黏膜(左)逐渐恶化到具有乳糜泻特征的绒毛萎缩和隐窝增生的扁平黏膜的横切面(右)。(B)导致乳糜泻的细胞免疫反应示意图。麦醇溶蛋白通过小肠的黏膜屏障(病毒或其他病原体感染增加其渗透性)到固有层(阶段1-3),与活化的tTG(阶段4)交叉反应。脱酰胺麦醇溶蛋白肽由抗原呈递细胞呈递(阶段5)并被辅助性T淋巴细胞识别(阶段6)。辅助性T淋巴细胞将信号传递给细胞毒性T细胞产生炎性细胞因子(阶段7和8)。这种激活导致慢性炎症和肠上皮的逐渐破坏。另外,活化的B细胞(阶段9)产生针对麦醇溶蛋白的抗体(阶段10)和针对tTG的抗体(阶段11)。tTG自身抗体的作用尚不清楚,目前被认为可加强其他抗原递呈T细胞的活化(阶段12)。tTG :组织型转谷氨酰胺酶。
T1DM是在遗传易感人群中由自身免疫反应所引起的,在一定程度上与CD的发病机制类似。越来越多的证据表明病毒(如肠道病毒)和其他环境因素(如饮食因素)与疾病的进展以及天然免疫系统的激活有关。现有假说提出组织型转谷氨酰胺酶的酶活性也在胰岛素分泌中发挥了一定作用,但尚需进一步探索。
四、共同的遗传学和环境因素
同卵双生子发生T1DM(约42%)和CD(约75-90%)的高度一致性是表明基因参与了T1DM和CD的最强有力证据。与诸多自身免疫性疾病相类似,位于第 6号染色体上的HLA基因在T1DM和CD中起主要作用,已知是这两种病症风险因素的HLA单体型是HLA-DRB1*04-DQA1*03:01-DQB1*03:02 (HLA-DR4-DQ8)和HLA-DRB1*03-DQA1*05:01-DQB1*02:01 (HLA-DR3-DQ2) ,约占整体遗传风险的50%。
但是,这些单体型HLA的不同组合可赋予T1DM和CD不同的患病风险。对T1DM而言,HLA-DR3-DQ2和HLA-DR4-DQ8携带者的患病风险最高,而CD的高危基因型则是HLA-DR3-DQ2纯合子。大多数T1DM与CD共患者携带基因型为HLA-DR3-DQ2和HLA-DR4-DQ8。
尽管携带单体型HLA-DR3-DQ2和HLA-DR4-DQ8其中之一是发生T1DM或CD所必需的,但其他基因的参与亦必不可少。在迄今为止最大的、纳入了超过8000名T1DM患者(包括成人和小孩)和2500例CD患者的全基因组关联研究中,26个非HLA基因位点发现与这两种疾病均有关联。这些基因位点中有很多编码免疫调节因子,在疾病中发挥保护性或诱发性的作用。
但是,遗传因素本身不能完全解释CD和T1DM的发生发展。该两种疾病发病率的快速增长被归咎于环境因素的变化。支持该观点的一个论据是生活在不同社会经济环境中基因型相似的人群,这两种疾病的患病风险不同。例如,俄罗斯卡累利阿比T1DM和CD的发病率要比与其接壤的芬兰低几倍。
T1DM相关风险因素以及CD中除麸质以外的其它触发因素仍不清楚。有一些迹象表明,病毒有可能在两种疾病中均发挥了一定作用,而接触饮食麸质的起始时间和剂量主要参与了CD的发生发展。部分研究发现了其他一些促成因素(包括诱发或保护性因素)还可能包括牛乳蛋白、肠道微生物失衡、剖腹产和婴儿的喂养习惯(母乳喂养和维生素D摄入)。此外,从更广泛的公共福利角度出发,轮状病毒疫苗似乎并未增加CD或T1DM风险,尽管仍处于推测阶段。
五、自身抗体的相关性
CD和T1DM的显著特征是患者血清中出现特异性自身抗体。在CD患者中,这些自身抗体由靶向抗麦醇溶蛋白修饰酶-组织型谷氨酰胺转移酶的那些特异性自身抗体组成,组织型谷氨酰胺转移酶在1997年被发现为先前已知的网状蛋白和肌内膜自身抗体的自身抗原。T1DM患者的自身抗体包括胰岛素自身抗体,胰岛细胞抗体,谷氨酸酸脱羧酶抗体(GADA),胰岛素瘤相关抗原-2抗体和抗锌转运蛋白T8抗体。
CD和T1DM自身抗体的主要区别在于它们的特异性。虽然组织型转谷氨酰胺酶自身抗体(tissue transglutaminase antibody, tTGA)对未经治疗CD的阳性预测率接近100%,而单一自身抗体阳性对T1DM的预测率仅为10-25%。但在T1DM患者亲属中存在多种自身抗体(即≥3)的阳性,其预测率可以高达75%。
值得注意的是,tTGA在没有出现完全的小肠病变时也可以出现或短暂出现。有一个科学假说表明,CD的免疫应答主要针对麦醇溶蛋白,但随后这种反应转变为产生tTGA的免疫应答。tTGA本身可随后与免疫系统相互作用导致自身免疫反应的增强。基于前瞻性TEDDY队列研究证据,大约三分之二的儿童在tTGA出现之前出现了胰岛细胞抗体。
这两种疾病都有一个较长的亚临床阶段,在临床症状出现前患者的血清中已经存在自身抗体。在T1DM患者中,症状出现时达70-90%的β细胞已经被破坏。同样,CD患者也可以在肠道受损之前出现长达10年的亚临床期。但与T1DM相反,CD患者小肠损伤的严重程度和组织型转谷氨酰胺酶浓度的相关性更为显著。此外,CD血清学阳性而仅有轻微的肠道组织损伤的个体,亦可以出现临床症状甚至并发症。
六、临床表现和诊断
体重减轻,口渴和脱水是T1DM的特征性症状,但是在非常年幼的孩子中也常表现的隐蔽不易识别。与T1DM不同的是,CD的症状更加多样化:除了常见的胃肠症状,如腹泻和腹痛外,还可有各种各样的肠外表现(表3)。在T1DM儿童中特别要注意识别CD的非典型或微妙征象,因为这些症状易被忽视或误认为是糖尿病本身引起而非合并了CD。事实上,多达三分之一的T1DM患者在诊断为CD之前已有超过5年的未被发现的CD症状。
随着对两种疾病共患认识的不断加深,开展了在T1DM儿童中的CD筛查,这可能有助于早期识别和减轻CD的临床表现。然而,这些患者在诊断时是否也存在较轻的小肠黏膜损伤是有争议的。许多研究发现,通过CD筛查诊断与临床症状发作后诊断为CD的T1DM患者的肠道黏膜病变没有差异。尽管如此,筛查确定的无CD症状的患者也可能有进展性的黏膜损伤,从而增加并发症的风险。
CD诊断的金标准被认为是基于十二指肠活检所见的绒毛萎缩和隐窝增生,但尚存在几个与组织学诊断标准应用相关的问题。例如:肠道黏膜病变可以表现为斑片状,这造成了活检样本分析的困难以及高错误率。此外,组织病理学结果的判定是主观的,而且并不是所有CD的肠道黏膜表现均是特征性的。
CD组织学诊断以及高特异性血清标志物开发所面临的挑战激发欧洲儿科胃肠病学会,肝病学和营养学会(ESPGHAN)开发了一种新的诊断方法。2012年ESPGHANCD的标准,即在具有高浓度tTGA(10倍于正常上限)的有症状的儿童中,通过阳性肌内膜自身抗体和乳糜泻型HLA基因型证实,可以在没有活检的情况下确立诊断。该标准也适用于T1DM儿童,但应该注意的是,在无症状个体和tTGA浓度较低的患者中,仍需小肠活检诊断。随后的证据验证了2012年ESPGHAN标准的可靠性,但该标准尚未在所有国家中被接受。
在T1DM儿童中,CD的诊断尤其具有挑战性。因为许多患者的tTGA呈弱阳性或者存在浓度波动,并且不总具有明显的肠道黏膜病变表现用于组织学的诊断。目前尚无足够证据表明需为这些患者提供相关诊断或饮食治疗的建议。总而言之,根据目前的经验,在T1DM儿童中CD的治疗选择应该基于个体情况进行个性化定制,并且要经过与儿童及其父母的仔细讨论后再实施。相比之下,T1DM患儿的诊断和治疗通常不会受到CD并存的严重影响。
七、T1DM患者CD的筛查
T1DM与CD的高度共患加之T1DM中CD常常被漏诊均支持在T1DM患儿中进行CD的筛查;然而,这种做法是否最佳还有待证实。需要更多特别是T1DM和无症状性CD患儿的长期预后方面的研究数据作为开展CD筛查的保证。一些正在进行的试验(NCT01566110,NCT03122093)旨在解决这个问题,其结果引起人们的热烈期待。
另一个重要的未解决的问题是,如能在出现T1DM征兆几年前通过筛查高危人群早期诊断CD,是否可以在某些情况下预防T1DM的发生。目前,各国指南对CD筛查建议有所不同。例如,英国国家健康和护理研究所,ESPGHAN,北美和英国儿科胃肠病学,肝病学和营养学会推荐为所有T1DM儿童进行CD筛查。相反,美国胃肠病学会(其指南主要针对成人)和美国糖尿病协会更加谨慎,建议仅对具有症状,临床体征或实验室证据提示存在CD的T1DM患者进行筛查。总体来说,对于T1DM患者的CD筛查方法在不同医生间似乎极为不同。
此外,尽管CD筛查工作普遍,但美国预防服务工作组的一项证据报告和系统评价声称尚无足够证据支持在无症状个体中推荐CD筛查。由于T1DM儿童中CD患病率高于普通人群,而且CD常常没有症状,美国糖尿病学会(ADA)指南推荐 T1DM儿童在糖尿病诊断后即应进行乳糜泻筛查。国际儿童青少年糖尿病学会(ISPAD)则推荐在T1DM诊断时进行乳糜泻筛查,并在之后每 5 年筛查一次。
越来越多的研究数据提示T1DM的CD筛查更符合 ISPAD 指南,而不是 ADA 指南。例如纽约西奈山医学院Evan Graber 博士及其同事进行了一项回顾性病例研究,该研究共纳入340 例T1DM 受试者,这些患者在T1DM时以及之后每年均进行CD自身抗体检查。研究发现在那些CD自身抗体阳性的患者中,有三分之一患者在T1DM诊断5年后才发现有CD。指出T1DM乳糜泻筛查方案可能需要包括在T1DM后前 5 年内进行更频繁的筛查。但对每例T1DM患者都进行筛查也是一个巨大的临床挑战。
另外,也有人认为,如果患者临床上还没有任何症状,生长发育良好,糖尿病也控制良好,为何要对其进行干预。由于在临床工作中,CD自身抗体阳性,但无任何临床症状的患者比例非常高,而且其中很多患者不愿意进行活检,也不愿遵循无麸质饮食,这使得医生经常困惑是否应该在临床实践中筛查乳糜泻。如不对CD自身抗体结果做任何处理,那么医生在制定后续的最佳方案时将面临巨大挑战,这也是亟待解决的矛盾,需要更多的医生在实际的临床工作中获得更多的研究证据以得到更为优化的筛查方案及处理策略。
八、长期并发症,治疗和随访
T1DM和CD治疗不足和依从性差与远期预后不佳有关。CD并发症的风险与年龄有关,儿童早期并发症包括釉质缺陷,生长不良和骨骼发育,而成人患者可能有神经系统疾病,骨质疏松症和不孕症(表3)。早期识别和治疗能否预防成年后这些并发症的发生尚不清楚。肠淋巴瘤的风险增加与成人难治性CD密切相关,难治性CD被定义为尽管接受严格的无麸质饮食仍有持续的症状和肠绒毛萎缩的存在。然而,这种情况非常罕见,因此没有充分的理由在无症状儿童中进行CD筛查。
T1DM和CD的共患进一步增加了并发症的风险。瑞典的一项研究发现,长病程CD(诊断≥15年)与T1DM患者死亡风险增加2.8倍相关。此外,CD可能是糖尿病视网膜病变和肾病早期发生的独立危险因素,有双重诊断的成年人更易发生高血压和冠状动脉疾病。无麸质饮食能否减少这些并发症的风险仍不清楚,但是已发现CD治疗不佳的T1DM患者易于发生骨密度减少。
CD的治疗包括严格避免含麸质谷物,包括小麦,黑麦和大麦,以及人为添加谷蛋白的食品。纯化的燕麦很可能被大多数患者所耐受。为了保证疾病的缓解,应尽可能减少患者每天摄入的膳食麸质。
但保持无麸质饮食,特别是在T1DM患者中可能是沉重的负担,因为这些患者在保证无麸质饮食的同时还需要谨慎的控制碳水化合物摄入量。这种饮食不仅非常昂贵,而且一旦不仔细计划还可能会导致营养不良。此外,许多无麸质包装食品中脂肪和糖含量较高,或含有其他有害健康的营养成分,使接受这种饮食的个体容易导致身体组成异常以及肥胖。鉴于T1DM患者已处于心血管和代谢并发症的风险中,故应特别注意营养欠佳这一特殊问题。
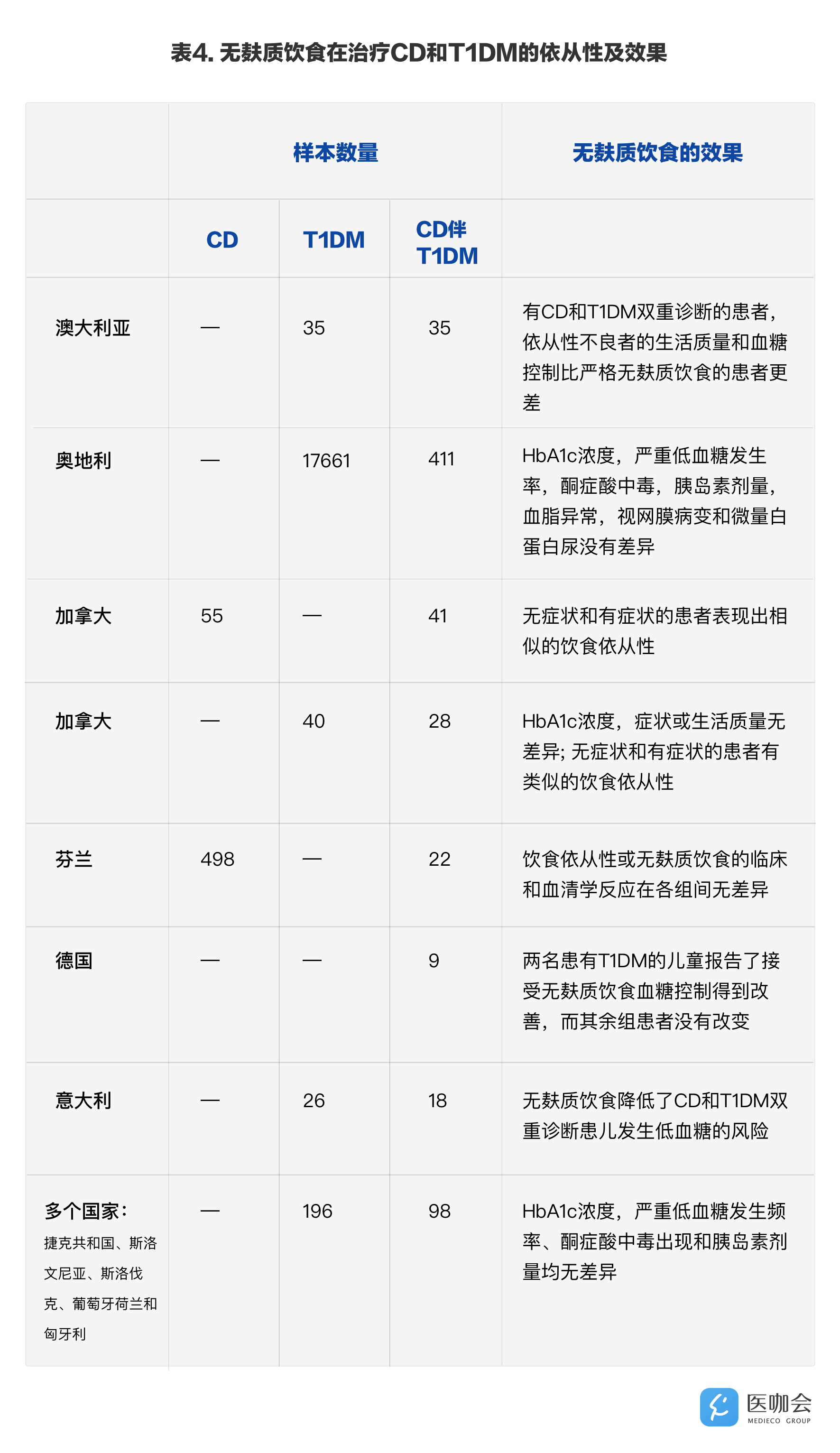
尽管面临这些挑战,目前无麸质饮食通常被患者所采用,并且未发现其对T1DM和CD共患儿的代谢平衡有害(表4)。实际上,严格的饮食控制甚至可以改善血糖和糖化血红蛋白(HbA1c)浓度,相反饮食依从性差使患者容易发生低血糖,生活质量下降。
在儿童和青春期这两种疾病都需要定期监测。T1DM患者通常每季度进行一次临床评估和治疗依从性评估。CD的随访则基于患者和家长适应饮食治疗的能力,其制定更加的个性化。一般而言,推荐的随访由临床评估(包括初次诊断后3-6个月实验室参数的检测),以及随后每年依从性和血清学反应的评估组成。由于在青春期时可能会面临饮食依从性的挑战,因此后续计划必须灵活并针对患者进行个性化制定。
T1DM和CD共患儿的最佳治疗需要儿科亚专业之间以及医生与其他医疗保健专业人员之间的有效协作,并应有一个在两种疾病状态下都具备专业知识的营养师参与。在CD诊断时给予饮食指导建议和无麸质饮食;如果显示患儿依从性不良或存在营养问题,应组织进一步的磋商。
其他重要的团队成员还应包括熟悉这两种疾病的专业护士,社会工作者,心理学家和儿科职业治疗师。由于单一的临床医生不会考虑这两种疾病或其可能的相互作用,因此从儿科到成人护理的精心策划的转变对于患有乳糜泻和1型糖尿病的青少年特别重要。
九、无麸质饮食的新挑战
在过去的十年中,CD的治疗中遇到了新的挑战。各种各样的特殊饮食——例如素食,低碳水化合物和古代饮食——越来越受欢迎。无麸质产品的广泛可用为CD患者带来了益处。然而不幸的是,如未经CD筛选或评估就开始无麸质饮食可能会严重影响随后的检测结果并混淆诊断。因此,治疗T1DM儿童的医生应建议在未减少饮食中麸质摄入量之前进行CD筛选。
T1DM和CD患儿的日常饮食在未来将变得更加多样化。因此医生需要确保这些患者与营养师的密切合作,保证营养充足及健康。迄今,有关T1DM和CD患儿食用食物的质量和数量的资料不足,所以有必要开展为T1DM与CD共患儿进行最佳营养治疗的前瞻性研究。
十、展望
目前基于替代或者联合限制性无麸质饮食的新型药物疗法正在研发中。CD患者,包括那些同时合并T1DM的患者,甚至在无麸质产品很好被利用的国家,也显示出对替代治疗方式的明确需求。目前已经引入了几种可能的具有不同作用机制的药物。特定的谷蛋白降解酶和肠道通透性调节剂(其防止免疫原麦醇溶蛋白肽进入体内)已经在成人的1期临床试验中进行了测试。尽管取得了一些有希望的结果,但这些候选药物的真实效果仍有待证实。
临床前沿的其他产品包括:合成的麸质螯合聚合物(可以防止麸质特异性CD4 + T细胞表位活化的特异性免疫),选择性组织型转谷氨酰胺酶抑制剂,和呈递麸质的HLA-DQ阻断剂。尽管前景可观,但目前尚无相关产品上市。此外,用新的长效胰岛素类似物,智能胰岛素泵和连续的葡萄糖监测系统治疗T1DM正在迅速发展。这些技术有可能改善伴有CD的T1DM儿童的生活质量和预后。
其中一个主要的有待解决的研究问题是,可否通过改变婴儿饮食来预防或减缓是CD和T1DM的发展。早期的饮食干预,如纯母乳喂养或使用水解配方替代常规配方在临床试验中均无效。但仍需要进一步的研究,尤其是早期起始无麸质饮食在降低T1DM风险的作用。
CD和T1DM的高度共患是否仅由共同的遗传背景所致,二者是否存在真正的因果关系尚存争议。发现这两种疾病之间可能的共同致病和环境因素将是非常重要的,这不仅对于疾病的预防具有重大意义,并且也可以增加对一般自身免疫性疾病发病机制的认识。
主要参考文献:
1. Kalle Kurppa, Anna Laitinen, Daniel Agardh. Coeliac disease in children with type 1 diabetes. The Lancet Child & Adolescent Health. 2018, 2(2 ):133-143.
2. Zhiyuan Zhao, Jing Zou, Lingling Zhao, Yan Cheng, Hanqing Cai, Mo Li, Edwin Liu, Liping Yu, Yu Liu*. Celiac Disease Autoimmunity in Patients with Autoimmune Diabetes and Thyroid Disease among Chinese Population. PLoS ONE. 2016,11(7): e0157510.
3. Zhao Z, Miao D, Waugh K, Taki I, Dong F, Liu E, Rewers M, Liu Y*, Yu L*. Higher Sensitivity and Earlier Identification of Celiac Disease Autoimmunity by a Nonradioactive Assay for Transglutaminase Autoantibodies. J Immunol Res. 2016:2904563
4. 邹婧,马漠,辛可嘉,刘煜.组织型转谷氨酰胺酶抗体对1型糖尿病患者乳糜泻的诊断价值及相关临床特点分析.中华糖尿病杂志. 2017,9(10):622-626.