胰岛素自身免疫性低血糖:诊断,鉴别诊断和治疗进展
中国研究型医院学会糖尿病学专业委员会联合医咖会推出:研医论道。针对糖尿病领域的指南、最新文献、会议资讯,学会专家深度解读,全方位剖析领域热点!第22期由北京清华长庚医院的肖建中教授带来『胰岛素自身免疫性低血糖』的综述。本栏目将持续更新,敬请关注!
低血糖是临床常见的症状。低血糖在糖尿病患者中占比很高,最少也超过40%,低血糖常发生在糖尿病前期胰岛素分泌延迟导致的反应性低血糖,也可发生在治疗糖尿病中降糖药物导致的低血糖。低血糖也可仅仅是胰岛素分泌增加导致,如胰岛素瘤或一些摄入促进胰岛素分泌的物质导致胰岛素分泌增多所致,胰岛素自身免疫有关的低血糖近来报道越来越多。
低血糖的诊断
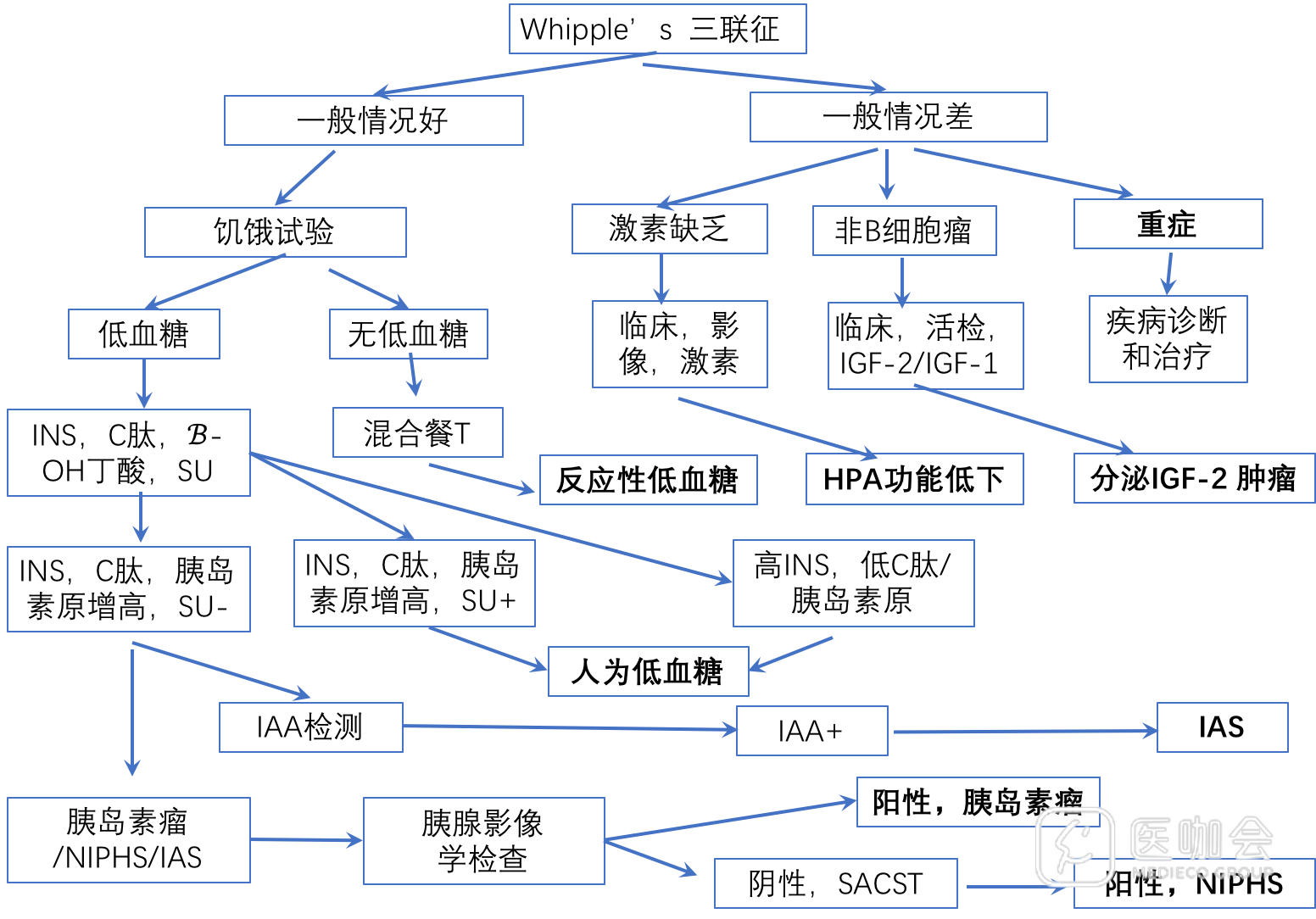
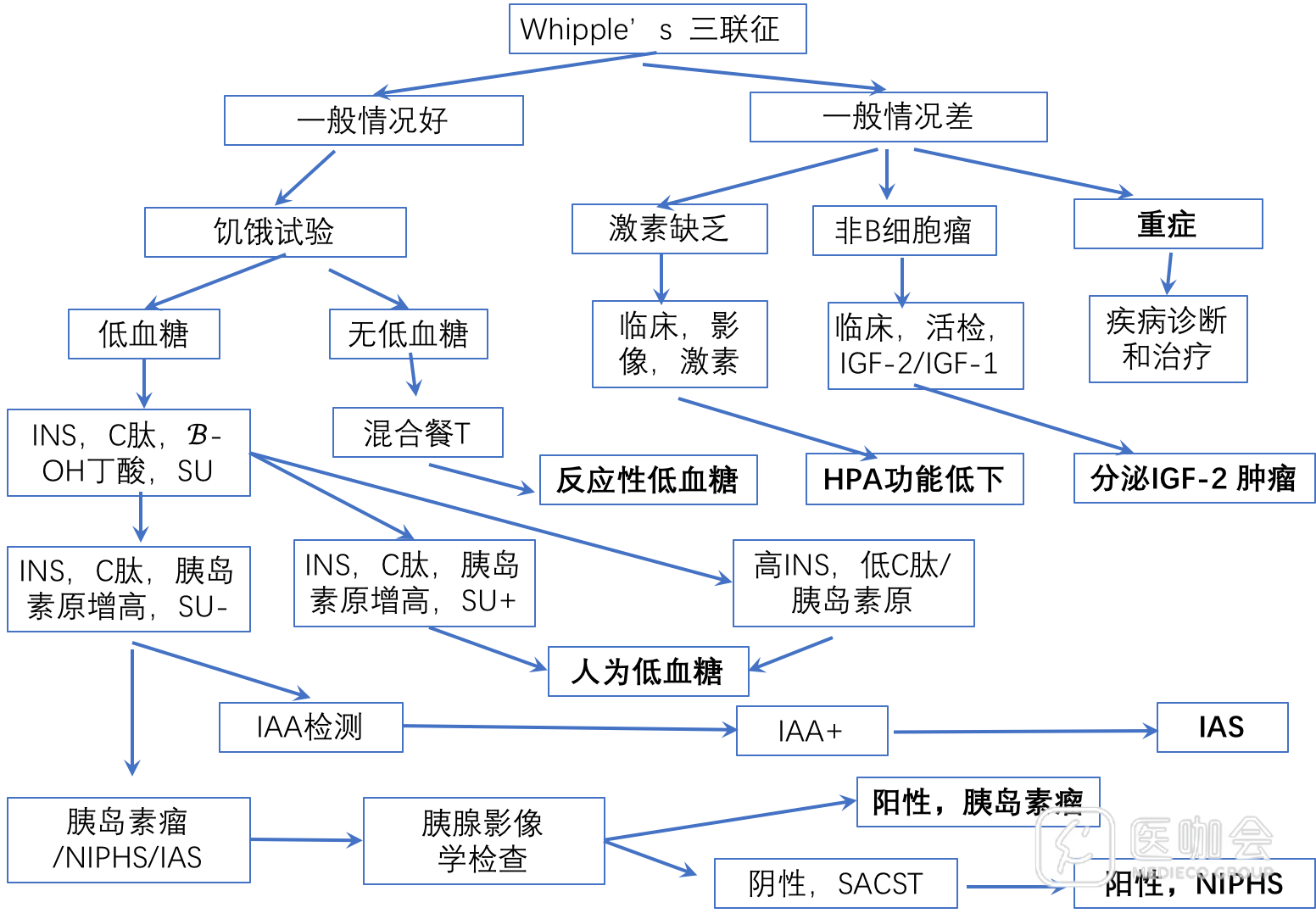
血糖平衡依赖于内分泌的调节机制。血糖降低时首先出现的变化是胰岛素分泌的减少或停止,再是胰高血糖素分泌的增加,再就是儿茶酚胺分泌增加,最后是皮质醇和生长激素分泌的增加。轻微低血糖时主要为交感神经兴奋的表现,如心慌、心动过速、手抖、出汗等症状,当调节机制失灵后,可以出现神经系统低血糖的表现,意识障碍和昏迷。低血糖的诊断依赖于Whipple’s 三联征:低血糖症状和体征、血糖测定<2.8 mmol/l和摄入糖分后缓解。
低血糖原因复杂。内源性胰岛素分泌增加(胰岛素瘤、非胰岛素瘤胰源性低血糖)、药物导致胰岛素水平升高(促分泌药物、胰岛素)、反应性低血糖、垂体或肾上腺功能不全低血糖、肿瘤导致IGF-2分泌增多的血糖,以及今天重点介绍的胰岛素自身免疫性低血糖。
低血糖的鉴别依赖于详细的病史、体检、化验检查、饥饿试验、影像学检查,其鉴别流程见图11。
图 1 低血糖诊断路径
SACST:选择性动脉钙刺激试验,NIPHS:非胰岛素瘤胰源性低血糖,SU:磺脲类
中国研究型医院学会糖尿病学专业委员会联合医咖会推出:研医论道。针对糖尿病领域的指南、最新文献、会议资讯,学会专家深度解读,全方位剖析领域热点!第22期由北京清华长庚医院的肖建中教授带来『胰岛素自身免疫性低血糖』的综述。本栏目将持续更新,敬请关注!
低血糖是临床常见的症状。低血糖在糖尿病患者中占比很高,最少也超过40%,低血糖常发生在糖尿病前期胰岛素分泌延迟导致的反应性低血糖,也可发生在治疗糖尿病中降糖药物导致的低血糖。低血糖也可仅仅是胰岛素分泌增加导致,如胰岛素瘤或一些摄入促进胰岛素分泌的物质导致胰岛素分泌增多所致,胰岛素自身免疫有关的低血糖近来报道越来越多。
低血糖的诊断
血糖平衡依赖于内分泌的调节机制。血糖降低时首先出现的变化是胰岛素分泌的减少或停止,再是胰高血糖素分泌的增加,再就是儿茶酚胺分泌增加,最后是皮质醇和生长激素分泌的增加。轻微低血糖时主要为交感神经兴奋的表现,如心慌、心动过速、手抖、出汗等症状,当调节机制失灵后,可以出现神经系统低血糖的表现,意识障碍和昏迷。低血糖的诊断依赖于Whipple’s 三联征:低血糖症状和体征、血糖测定<2.8 mmol/l和摄入糖分后缓解。
低血糖原因复杂。内源性胰岛素分泌增加(胰岛素瘤、非胰岛素瘤胰源性低血糖)、药物导致胰岛素水平升高(促分泌药物、胰岛素)、反应性低血糖、垂体或肾上腺功能不全低血糖、肿瘤导致IGF-2分泌增多的血糖,以及今天重点介绍的胰岛素自身免疫性低血糖。
低血糖的鉴别依赖于详细的病史、体检、化验检查、饥饿试验、影像学检查,其鉴别流程见图11。
图 1 低血糖诊断路径
SACST:选择性动脉钙刺激试验,NIPHS:非胰岛素瘤胰源性低血糖,SU:磺脲类
定义与病因
胰岛素自身免疫低血糖综合征(insulinautoimmune hypoglycemia syndrome, IAS)是指未用胰岛素的患者,反复发作低血糖症状并检测出低血糖,同时血液中检测出胰岛素自身抗体(insulin autoimmune antibody,IAA)的情况。
自从1970年平田(Hirata)首次描述由于服用含有巯基药物导致的低血糖以来2,3,IAS反复被报道。这类药物主要包括甲巯咪唑、巯甲丙脯酸、异烟肼、肼苯达嗪、谷胱甘肽、青霉胺、亚胺培南和α-硫辛酸等。IAS还可能合并自身免疫疾病,如Grave’s病,系统性红斑狼疮、多发性骨髓瘤、溃疡性结肠炎、类风湿性关节炎和垂体功能低减等疾病。
HLA DRB1*406、DRB1*0403与DRB1*0407及 HLA-DQ等位基因型、DQA1*0301或DQB1*0302 等位基因被认为与IAS易感相关。一些自身免疫性疾病可能导致产生模拟胰岛素作用的胰岛素受体抗体,导致低血糖的发生,但者不是IAS。由于近来有些在应用胰岛素后产生低血糖的报道,是否这些患者,也可以像其它药物导致的IAS一样,归于同类呢?
诊断标准
一般认为,诊断IAS需满足以下标准4,5:(1)典型或较严重自发性低血糖临床表现。(2)发作时血糖明显偏低。(3)从未使用外源胰岛素,但血液中存在高滴度IAA。(4)RIA或IRMA测定总免疫反应性胰岛素(IRI)显著升高。(5)OGTT呈糖耐量减低和(或)诱发低血糖。
鉴别诊断
IAS需要与胰岛素瘤和降糖药物导致的低血糖相鉴别。两者共同的表现是反复发生低血糖甚至严重低血糖,血胰岛素和C肽水平升高。由于胰岛素瘤通常比较小,很多患者影像学也无发现,因此最重要的鉴别点是IAS可以检测到抗胰岛素的自身抗体(图1)。
IAS在糖尿患者中鉴别可能会比较困难。如果患者用胰岛素后出现低血糖,又表现为使用含巯基药物如α-硫辛酸后出现低血糖,尽管IAA阳性,但患者有胰岛素使用的历史,怎么鉴别?停用胰岛素,或再使用含巯基的药物再次出现低血糖,同时高的结合力的抗体和HLA易感等位基因的检出,提示“IAS”的诊断。
也有使用胰岛素的患者出现IAA抗体同时发生低血糖,没有发现其他可能产生IAS的原因的情况。患者停用胰岛素1周以上,患者仍有低血糖发作和持续的IAA(+),而且能排出外源性胰岛素所致低血糖。但按过去的标准,这2种情况是不能诊断IAS的,要考虑外源性胰岛素引起的IAS(Exogenous insulin autoimmune syndrome,EIAS),这种情况变得越来越多。
IAS发生时IAA 有高的结合能力(capacity)和低亲和力(affinity)的特点,其与胰岛素结合,导致游离胰岛素作用下降,血糖升高,导致更多的胰岛素释放,当胰岛素与抗体解离时,机体在大量的游离激素作用下发生低血糖。IAS引起的低血糖多发生在吸收,空腹和运动也可诱发低血糖。
发病机理
含巯基药物因本身或分解后所含的巯基能与胰岛素分子的二硫键相互作用,使内源性胰岛素发生变构,触发免疫反应而产生IAA。胰岛素是否也可能诱发类似IAS的抗体?IAS的诊断是否不需要排除胰岛素使用的情况?事实上,外源性胰岛素的使用可以刺激机体产生胰岛素抗体(insulin antibody)。在应用胰岛素的患者中检出率较高,在使用胰岛素2周左右就可以检出。
研究发现,使用含有精蛋白的胰岛素,产生IAA的可能增加2-3倍6。这种抗体通常亲和力比较高,结合能力比较低,这些患者表现为高血糖难以控制,胰岛素效果不佳。但少数患者产生的抗体也有高结合能力,低亲和力情况。低血糖发作不可预测或不规律,胰岛素和C肽水平不平行,要考虑外源性胰岛素引起的EIAS。
Devendra等7发现新诊断且未接受胰岛素治疗的T1DM 患者、IAS患者和已注射胰岛素治疗的T2DM 患者血清中的IAA或IA实际识别胰岛素分子的不同抗原决定簇。高亲和力IAA结合的关键氨基酸残基为胰岛素A链的8-13残基,可结合胰岛素原。而大多数低亲和力IAA与胰岛素结合依赖于B链羧基端28-30残基8。同样的IAS患者在不同疾病阶段体内其IAA亦有不同。
低血糖发作期间IAS患者体内IRI水平极高,通过 Scatchard分析结果显示,当低血糖严重时,高亲和力/低结合力抗体可转化为低亲和力/高结合力抗体。当低血糖缓解时,总IRI降低,高亲和力(k1)/低容量(b1)抗体群体表现出较高的亲和力常数并且结合力较低9。
可以看出,无论是否使用胰岛素,是抗体本身的特性决定是否引起低血糖的发作。只要排除外源性胰岛素过量使用,EIAS也是IAS。可能是时候将IAS诊断标准进行修改,即无需排除使用胰岛素历史,将胰岛素后产生的EIAS,归于IAS同类。
治疗
IAS的治疗主要是停用可疑的药物,多数人会自发缓解。在EIAS情况下,停用胰岛素或换胰岛素可能是治疗的选择。部分IAS和EIAS患者严重低血糖反复发作,可能还需要免疫抑制治疗,也有使用血浆置换治疗。
糖皮质激素是常用的免疫抑制药物,也有使用免疫抑制剂硫唑嘌呤和抗CD-20 单克隆抗体Rituximab 的报道。图2是一例患者使用泼尼松 1mg/kg 体重 3个月后再Rituximab,抗胰岛素IG水平、测定的胰岛素、估计总的胰岛素和游离胰岛素的变化监测。伴随抗体的下降,低血糖发作缓解10。
图2 一例IAS治疗过程中胰岛素抗体及胰岛素的变化
参考文献
1.Kandaswamy L, Raghavan R, Pappachan JM.Spontaneous hypoglycemia: diagnostic
evaluation and management. Endocrine. 2016Jul;53(1):47-57. doi:
10.1007/s12020-016-0902-0.
2.Hirata Y & Ishizu H. Elevatedinsulin-binding capacity of serum proteins in a case with spontaneoushypoglycemia and mild diabetes not treated with insulin. Tohoku Journal ofExperimental Medicine 1972 107 277–286. doi:10.1620/tjem.107.277
3.Ismail AA. The insulin autoimmunesyndrome (IAS) as a cause of hypoglycaemia: an update on the pathophysiology,biochemical investigations and diagnosis. Clin Chem Lab Med. 2016 Nov1;54(11):1715-1724. doi: 10.1515/cclm-2015-1255.
4.LupsaB C, Chong A Y, Cochran E K, et al. Autoimmune forms of hypoglycemia.[J].Medicine, 2009,88(3):141.
5.David Church, Luís Cardoso, SoniaBradbury,et al. Diagnosis of insulin autoimmune syndrome using polyethyleneglycol precipitation and gel filtration chromatography with ex vivo insulinexchange
Clin Endocrinol (Oxf) 2017 Mar; 86(3):347–353.
6.Nishimura H, Iizuka K, Takeda J.Protamine-containing insulin but not analog insulin and duration of insulin useare risk factors for the production of insulin autoantibodies in insulin-treatedpatients with diabetes mellitus. Endocr J. 2014;61(6):635-40.
7.Devendra D, Galloway T S, Horton S J, etal. The use of phage display to distinguish insulin autoantibody (IAA) frominsulin antibody (IA) idiotypes[J]. Diabetologia, 2003,46(6):802-809.
8.Achenbach P, Koczwara K, Knopff A, et al.Mature high-affinity immune responses to (pro)insulin anticipate the autoimmunecascade that leads to type 1 diabetes[J]. Journal of Clinical Investigation,2004,114(4):589.
9.Eguchi Y, Uchigata Y, Yao K, et al.Longitudinal Changes of Serum Insulin Concentration and Insulin AntibodyFeatures in Persistent Insulin Autoimmune Syndrome (Hirata's Disease)[J].Autoimmunity, 2009,19(4):279-284.
10.Church D, Hunter RW, Lyall M,et al. Resolution of Hypoglycemia andCardiovascular Dysfunction After Rituximab Treatment of Insulin AutoimmuneSyndrome. Diabetes Care. 2017 Jul;40(7):e80-e82. doi: 10.2337/dc17-0264.
学会专家介绍